X、Y、Z、Q、R、W为周期表中前四周期的元素,其原子序数依次增大。已知:X的基态原子核外电子有6种运动状态,Y的气态氢化物水溶液呈碱性,Z元素基态原子的s能级与p能级上的电子数相等,Q的一种核素质量数为37,中子数为20,R2+与Z—具有相同的核外电子排布,W原子核外最外层只有1个电子,其余各层均充满电子。回答下列问题:
(1)W在周期表中位于 区,其基态原子价电子排布式为 。
(2)X、Y、Z的第一电离能由大到小的顺序为___ _(用元素符号表示)。
(3)Y、Q两种元素可形成YQ3形化合物,其中心原子杂化方式为 ,分子的空间构型为 。
(4)Y的氢化物易溶解在Z的氢化物中,其原因是 。
(5)已知YZ2+写XZ2互为等电子体,写出YZ2+的电子式 。
(6)Y的一种液态氢化物(Y2H4)与液态Y2Z4发生反应生成Y2(g)和H2Z(l):反应 中若形成1molπ键放热a KJ,写出该反应的热化学方程式 。
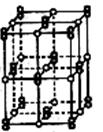
(7)RX2晶体的晶胞结构与NaCl晶体相似(如图示),但RX2晶体中哑铃形X22-的存在,使晶胞沿一个方向拉长。RX2晶体中1个R2+周围距离最近的X22-数目为 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号