室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,下列说法错误的是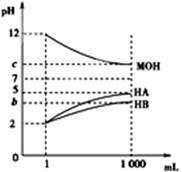
A.HA为强酸,HB为弱酸
B.若b+c=14,则MOH为弱碱
C.若c=9,则稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为HA>MOH>HB
D.若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)=c(M+)
室温下,将pH=2的两种酸溶液HA、HB和pH=12的碱溶液MOH各1 mL,分别加水稀释到1 000 mL,其pH的变化与溶液体积的关系如图,下列说法错误的是
A.HA为强酸,HB为弱酸
B.若b+c=14,则MOH为弱碱
C.若c=9,则稀释后的三种溶液中,由水电离的氢离子的浓度的大小顺序为HA>MOH>HB
D.若c=9,将稀释后的HA溶液和MOH溶液取等体积混合,则所得溶液中c(A-)=c(M+)
试题篮
()