铁酸锌(ZnFe2O4)是对可见光敏感的半导体催化剂,其实验室制备原理为:
Zn2++2Fe2++3C2O42-+6H2O ZnFe2(C2O4)3·6H2O↓ (a)
ZnFe2(C2O4)3·6H2O↓ (a)
ZnFe2(C2O4)3·6H2O  ZnFe2O4 + 2CO2↑+4CO↑+6H2O (b)
ZnFe2O4 + 2CO2↑+4CO↑+6H2O (b)
已知:ZnC2O4和FeC2O4难溶于水。
(1)上述制备原理中不属于氧化还原反应的是 (选填:“a”或“b”)。
(2)制备ZnFe2(C2O4)3·6H2O时,可选用的药品有:
Ⅰ.(NH4)2Fe(SO4)2·6H2O Ⅱ.ZnSO4·7H2O Ⅲ.(NH4)2C2O4·7H2O。
①称量药品时,必须严格控制n(Fe2+)/n (Zn2+)= 。
②选用的加料方式是 (填字母)。
a.按一定计量比,Ⅰ、Ⅱ、Ⅲ同时加入反应器并加水搅拌,然后升温至75℃。
b.按一定计量比,Ⅰ、Ⅲ同时加入反应器加水配成溶液,然后加入Ⅱ,再升温到75℃。
c.按一定计量比,将Ⅰ、Ⅱ混合并配成溶液甲,Ⅲ另配成溶液乙,甲、乙同时加热到75℃,然后将乙溶液缓慢加入甲溶液中,并持续搅拌。
(3)从溶液中分离出ZnFe2(C2O4)3·6H2O需过滤、洗涤。已洗涤完全的依据是 。
(4)ZnFe2(C2O4)3·6H2O热分解需用酒精喷灯,还用到的硅酸盐质仪器有 。
(5)某化学课外小组拟用废旧干电池锌皮(含杂质铁),结合下图信息从提供的试剂中选取适当试剂,制取纯净的ZnSO4·7H2O。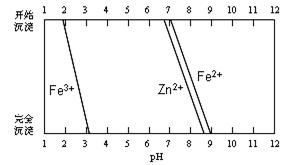
实验步骤如下:
①将锌片完全溶于稍过量的3mol·L-1稀硫酸,加入 (选填字母,下同)。
A.30%H2O2 B.新制氯水 C.FeCl3溶液 D.KSCN溶液
②加入 。
A.纯锌粉 B.纯碳酸钙粉末 C.纯ZnO粉末 D.3mol·L-1稀硫酸
③加热到60℃左右并不断搅拌。
④趁热过滤得ZnSO4溶液,再蒸发浓缩、冷却结晶,过滤、洗涤、干燥。
其中步骤③加热的主要目的是 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号