氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下: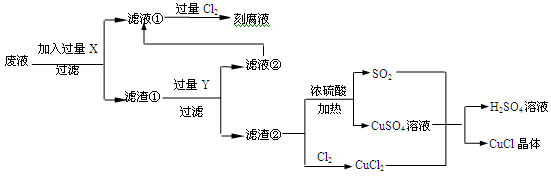
(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
______FeS2+______ O2 ______SO2+______Fe2O3
O2 ______SO2+______Fe2O3
(2)写出生产过程中X__________ ,Y___________ (填化学式)。
(3)产生CuCl的化学方程式_______________________________________________。
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点。如此再重复二次测得数据如下:
(已知:CuCl + FeCl3 ══CuCl2 + FeCl2 Fe2+ + Ce4+ ══ Fe3+ + Ce3+ )
| |
1 |
2 |
3 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) |
23.85 |
24.35 |
23.95 |
④数据处理:计算得CuCl的纯度为__________。(平行实验结果相差不能超过0.3%)








 粤公网安备 44130202000953号
粤公网安备 44130202000953号