重晶石(BaSO4)是重要的化工原料,用重晶石制备氢氧化钡晶体[Ba(OH)2·8H2O]的流程如下: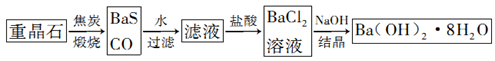
已知:Ba(s)+S(s)+2O2(g) BaSO4(s)ΔH="-1" 473.2 kJ·mol-1
BaSO4(s)ΔH="-1" 473.2 kJ·mol-1
2C(s)+O2(g) 2CO(g) ΔH="-221" kJ·mol-1
2CO(g) ΔH="-221" kJ·mol-1
Ba(s)+S(s) BaS(s) ΔH="-460" kJ·mol-1
BaS(s) ΔH="-460" kJ·mol-1
(1)写出煅烧时发生反应的热化学方程式: 。
(2)写出氢氧化钡晶体与氯化铵混合反应的化学方程式: 。
(3)为检测煅烧时产生的CO,可将煅烧产生的气体通入PbCl2溶液中,出现黑色沉淀并产生一种无色无味能使澄清石灰水变浑浊的气体,试写出该反应的化学方程式:。
(4)向BaSO4沉淀中加入饱和Na2CO3溶液,充分搅拌,弃去上层清液,如此处理多次,可使BaSO4全部转化为BaCO3。发生的反应可表示为BaSO4(s)+ CO32-(aq) BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
BaCO3(s)+ SO42- (aq)。现有0.20 mol BaSO4,加入1.0 L 2.0 mol·L-1饱和Na2CO3溶液处理,假设c(SO42-)起始≈0,平衡时,平衡常数K=4.0×10-2,求反应达到平衡时发生转化的BaSO4的物质的量。(不考虑溶液体积变化与离子水解,写出计算过程,结果保留2位有效数字)
(5)试从平衡的角度解释BaSO4可转化为BaCO3的原因: 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号