[化学一物质结构与性质](13分)钛被称为“国防金属’’和“生物金属”,是重要的结构材料。
(1)基态钛原子的核外电子排布式是_______________________________,钛所在的周期中第一电离能最小的元素是______________________________.
(2)金红石(TiO2)的熔点 ,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
,用熔盐法直接电解金红石可获得金属钛,金红石所属的晶体类型是______________________________________晶体。
(3)TiCl4能与NH4CI反应生成配合物(NH4)2[TiCl6]。此配合物中,形成配位键时提供孤对电子的有_____________.(填元素符号),空间构型呈正四面体的微粒是___________。
(4)TiO2+与H2O2在稀酸中反应生成橘红色的[TiO(H2O2) ] 2+离子,可用于钛的定性检验。
[TiO(H2O2) ] 2+中不含有_____________________________.
A.极性键
B.非极性键
C.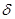 键
键
D. 键
键
E.离子键
(5)H2O2分子可看成H2O分子中的一个H被OH所取代,下列关于H2O2的说法正确的是______
A.H2O2分子结构对称为非极性分子
B.I mol H2O2最多能形成2mol氢键
C.H2O2不稳定是因为氢键的键能较小
D.H2O2分子的空间构型为直线形








 粤公网安备 44130202000953号
粤公网安备 44130202000953号