用软锰矿(主要成分为MnO2)生产高锰酸钾产生的锰泥中,还含有18%的MnO2、3%的KOH(均为质量分数),及少量Cu、Pb的化合物等,用锰泥可回收制取MnCO3,过程如图: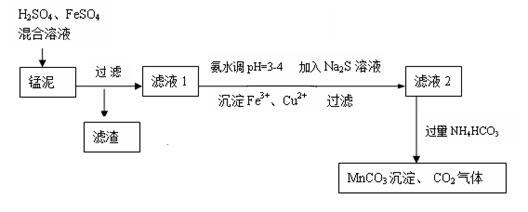
(1)用软锰矿(主要成分为MnO2)生产高锰酸钾过程中,粉碎软锰矿的主要目的是______ 。
(2)锰泥中加入H2SO4、FeSO4混合溶液,反应的离子方程式是: __。
(3)经实验证明:MnO2稍过量时,起始H2SO4、FeSO4混合溶液中c(H+)/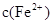 <0.7时,滤液1中能够检验出有Fe
<0.7时,滤液1中能够检验出有Fe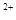 ;
;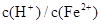 ≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①、②、③:
≥0.7时,滤液1中不能检验出有Fe2+。根据上述信息回答①、②、③:
①检验Fe2+是否氧化完全的实验操作是:__________________________ 。
②生 产时H2SO4、FeSO4混合溶液中c(H+)/c(Fe2+)控制在0.7~1之间,不宜过大,请结合后续操作从节约药品的角度分析,原因是:____ __。
③若c(H+)/c(Fe2+)>1,调节c(H+)/c(Fe2+)到0.7~1的最理想方法是:______(填序号)
a.NaOH溶液 b.铁粉 c.MnO
(4)写出滤液2中加入过量NH4HCO3反应的离子方程式:___ ____ 。
(5)上述过程锰回收率可达95%,若处理1740 kg的锰泥,可生产MnCO3__________kg(已知相对分子质量:MnO2 87;MnCO3 115)。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号