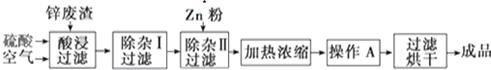
(13分)工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质,并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有________。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是_____。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为______。为控制上述pH范围可选择加入的试剂或药品是________。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是_______。“操作A”的名称是_______。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02mol/L,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于___________。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号