研究化肥的合成、废水的处理等有现实的重要意义。
(1)工业生产中,以NH3为原料制硝酸,写出工业生产硝酸最后一步的化学方程式 。
(2)甲、乙、丙三个化肥厂生产尿素所用的原料不同,但生产流程相同:
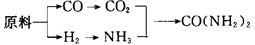
已知:CO+H2O CO2+H2;
CO2+H2;
按工业有关规定,利用原料所制得的原料气H2和CO2的物质的量之比,若最接近合成尿素的原料气NH3(换算成H2的物质的量)和CO2的物质的量之比,则对原料的利用率最高。现有甲、乙、丙三家工厂生产原料如下:
甲厂以焦炭和水为原料;
乙厂以天然气和水为原料;
丙厂以石脑油(主要成分为C5H12)和水为原料。
请根据上述信息判断甲、乙、丙三个工厂哪个工厂对原料的利用率最高:________(填“甲”、“乙”或“丙”)。
(3)将工厂废气中产生的SO2通过下列流程,可以转化为有应用价值的硫酸钙等。
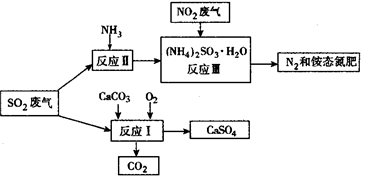
①写出反应Ⅰ的化学方程式:_________________________________。
②生产中,向反应Ⅱ的溶液中加入强还原性的对苯二酚等物质,目的是_____________。
③检验经过反应Ⅲ得到的铵态氮肥中SO42-所用试剂是_______________________。
(4)为减少环境污染,工业上也常用Na2CO3溶液吸收制取HNO3产生的尾气中的NO2,生成NaNO3、NaNO2和一种气体,写出反应的化学方程式 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号