用0.2000 mol/L的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
①用蒸馏水洗涤碱式滴定管,注入0.2000 mol/L的标准NaOH溶液至“0”刻度线以上;②固定好滴定管并使滴定管尖嘴充满液体;③调节液面至“ 0”或“0”刻度线稍下,并记下读数;④量取20.00 mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;⑤用标准液滴定至终点,记下滴定管液面读数。⑥重复以上滴定操作2-3次。请回答:
(1)以上步骤有错误的是(填编号)________,该错误操作会导致测定结果_________ (填“偏大”、“偏小”或“无影响”)。
(2)步骤④中,量取20.00 mL待测液应使用________(填仪器名称),在锥形瓶装液前,留有少量蒸馏水,测定结果____________(填“偏大”、“偏小”或“无影响”)。
(3)步骤⑤滴定时眼睛应注视____________;判断到达滴定终点的依据是:________。
(4)以下是实验数据记录表
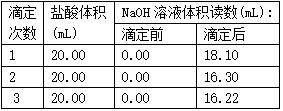
从表中可以看出,第1次滴定记录的NaOH溶液体积明显多于后两次的体积,其可能的原因是
| A.滴定前滴定管尖嘴有气泡,滴定结束无气泡 |
| B.锥形瓶用待测液润洗 |
| C.NaOH标准液保存时间过长,有部分变质 |
| D.滴定结束时,俯视计数 |
(5)根据表中记录数据,通过计算可得,该盐酸浓度为:____________mol/L








 粤公网安备 44130202000953号
粤公网安备 44130202000953号