亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业.它在碱性环境中稳定存在.工业设计生产NaClO2的主要流程如下:
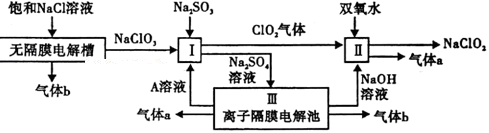
(1)A的化学式是 ,装置Ⅲ中A在 极区产生.
(2)Ⅱ中反应的离子方程式是
(3)通电电解前,检验Ⅲ中阴离子的方法和步骤是
(4)为防止Ⅱ中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是
(填字母编号).
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07×10-2 mol·L-1,Ⅱ中反应所得NaClO2
溶液(含少量NaOH)的pH=13,则溶液中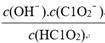 =
=
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200mL0.5mol·L-1的CuSO4溶液,生成铜3.2g,此时所得溶液中离子浓度由大到小的顺序是








 粤公网安备 44130202000953号
粤公网安备 44130202000953号