经检测某工厂的酸性废水中所含离子及其浓度如下表所示:
| 离子 |
Fe3+ |
Cu2+ |
SO42- |
Na+ |
H+ |
| 浓度/(mol/L) |
2×10-3 |
1×10-3 |
1×10-2 |
2×10-3 |
|
(1)c(H+)= mol/L。
(2)为了减少污染并变废为宝,工程师们设计了如下流程,回收铜和绿矾(FeSO4·7H2O)。
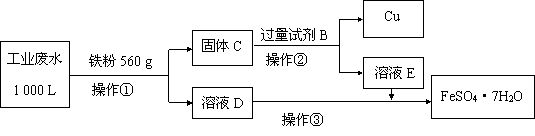
① 工业废水中加入铁粉后,反应的离子方程式为:
Fe + Cu2+ ="=" Fe2+ + Cu、 、 。
② 试剂B是 。
③ 操作③是蒸发浓缩、冷却结晶、 ,最后用少量冷水洗涤晶体,在低温下干燥。
④ 通过检验溶液D中Fe3+来判断废水中Fe3+是否除尽,实验方法是 。
⑤ 获得的FeSO4·7H2O需密闭保存,原因是 。
⑥ 上述1000 L废水经处理,可获得 FeSO4·7H2O的物质的量是 mol。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号