化学活动课上同学们对金属的性质及合金的成份进行了探究,请你参与。
(1)取等质量的金属,分别加入足量稀硫酸,完成如表四组实验。
药品/序号 |
A |
B |
C |
D |
金属 |
铜粉 |
锌粉 |
锌粉 |
镁粉 |
稀硫酸 |
9.8%硫酸 |
19.6%硫酸 |
9.8%硫酸 |
9.8%硫酸 |
①写出实验中一个反应的化学方程式 。
②根据表中 实验(选填序号),即可判断Mg、Cu、Zn三种金属的活动性顺序。
(2)探究合金的成份,某合金可能由Mg、Cu、Zn、Al四种金属中的两种组成。
[提出问题]合金由哪两种金属组成?
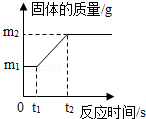
[实验探究]①取该合金m1g,在足量氧气中反应,生成固体质量为m2g,m1和m2的关系如图所示,则(m2﹣m1)g表示的意义是 。
②再向m2g的固体中加入稀硫酸,微热,固体全部溶解,得溶液M,继续进行如下实验,补充完成内容。
实验操作 |
实验现象 |
结论和化学方程式 |
向M中加入ag铁粉、搅拌 |
化学方程式: M中的溶质: |
|
过滤,把所得固体洗涤、干燥,称其质量也为ag,并向此固体中加入稀硫酸 |
无明显现象 |
[分析结论]③若m1=4,m2=7.2,结合上述实验分析,合金的成份是 。
(3)根据上述实验总结金属的化学性质 。








 粤公网安备 44130202000953号
粤公网安备 44130202000953号