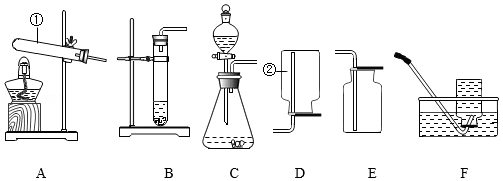
根据下列仪器装置,回答问题。

(1)写出仪器名称:①为 ,②为 。
(2)实验室用MnO2和双氧水制取O2,反应的化学方程式为 ;装入药品前必须进行的操作是 ;实验室制取H2可选用装置 (填字母序号)。
(3)实验室用混有MnO2的KClO3固体制取O2,MnO2在反应中起 作用。
(4)实验室可用 (填物质名称)干燥CO2。用装置E进行CO2的部分性质实验:将干燥的紫色石蕊试纸放在 (选填“a”“d”)处,并与b处现象对比,可说明CO2能与水反应;c处发生反应的化学方程式为 。
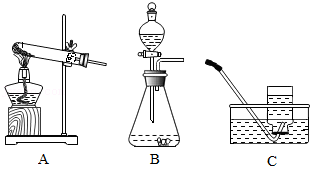
请根据下列实验装置图回答问题。
(1)写出标号仪器的名称:①是 ,②是 。能用装置E收集的气体应具有的性质是 。
(2)实验室用过氧化氢溶液和MnO2混合制O2时MnO2的作用是 。收集较纯净的氧气,装置可用 (填字母)。用锌与稀硫酸反应制取氢气的化学方程式为 。
(3)实验室可用铜片与浓硝酸在常温下反应制取少量二氧化氮(NO2)。通常状况下,二氧化氮是红棕色气体,溶于水时与水反应生成硝酸和一氧化氨(NO)。
①制取NO2的发生装置可用 (填字母)。
②收集NO2不用装置F的原因是 (用化学方程式表示)。
O2是人类生活不可缺少的物质,制取O2的方法很多。请回答下列问题:
(1)KMnO4分解法:该反应的化学方程式为 ;
(2)KClO3分解法:应选用图中的 (填图中装置对应的字母)作发生装置;
(3)H2O2分解法:常温下H2O2分解缓慢,通常加入少量MnO2,则MnO2的作用为 ;
(4)可以用C所示装置来收集O2,体现了O2 的性质;
(5)已知N2的沸点为﹣196℃,O2的沸点为﹣183℃。工业上在低温下加压,先使空气液化,然后蒸发,则O2为 (填“先”或“后”)蒸发出来的气体。
化学来源于生活,同学们对生活中的一些现象产生兴趣,在老师指导下开展了系列探究实验活动:
活动一:红砖粉末能做催化剂吗?
实验步骤 |
实验现象 |
实验结论和解释 |
|
小明 |
A试管装有5mL的5%过氧化氢溶液 B试管装有5mL的5%过氧化氢溶液,再加入a克的红砖粉末。 |
A中无明显现象,B中产生大量能使带火星的木条复燃的气体。 |
(1)产生的气体是 。 (2)红砖粉末能改变过氧化氢的分解速率。 |
小红 |
待反应停止时,向B试管中重新加入5%的过氧化氢溶液。 |
(1)又产生大量能使带火星的木条复燃的气体。 |
红砖粉末的 在反应前后没有发生变化。 |
【实验反思】小明和小红通过上述实验,一致认为红砖粉末可以做分解过氧化氢溶液的催化剂,但小强认为小明和小红说法不严谨,理由是 。
活动二:水壶内部的白色固体是什么?
【查阅资料】水在加热或长久放置时,溶于水中的可溶性钙和镁的化合物会生成沉淀(水垢)。
【假设与猜想】
猜想Ⅰ:CaCO3
猜想Ⅱ:Mg(OH)2
猜想Ⅲ: (填化学式)
【实验与探究】取少量白色固体样品(不考虑杂质和微溶物对实验的影响)于试管中,向其中加入足量稀盐酸,现象:白色固体溶解,有气泡产生,根据以上现象,小华认为:猜想Ⅰ正确。小雪却认为小华的结论不严谨,经过两人反复讨论,进一步设计了如表实验。
实验步骤 |
实验现象 |
实验结论 |
取上述实验中的上层清液于试管中,滴加足量NaOH溶液 |
|
猜想Ⅰ成立 |
有白色沉淀产生 |
猜想Ⅲ成立 |
验证猜想Ⅲ成立时产生白色沉淀的反应化学方程式是 。
活动三:验证NaOH变质有方法?
【方法归纳】同学们通过实验探究,认为验证氢氧化钠变质可以从验证反应后的生成物入手,例如:加足量稀盐酸等出现气泡,加氯化钙溶液等出现白色沉淀等来判别;也可以通过反应过程中温度、压强等变化来判别。
【学科渗透】按如图所示装置进行实验。实验前U型管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U型管中的液面 。
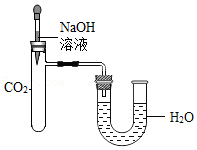
据此,小明同学得出“CO2与NaOH发生了化学反应”的结论。小红认为小明结论证据不充足,理由是 。
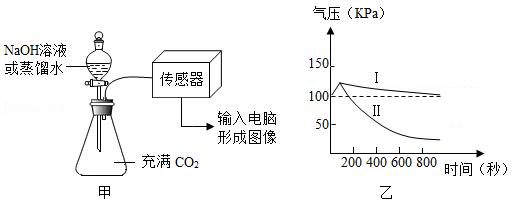
【再次实验】同学们用压强传感器研究水或等量NaOH溶液分别吸收CO2的效果,实验装置及测定结果如甲图和乙图所示。图乙中 (填“Ⅰ”“Ⅱ”)表示等量NaOH溶液吸收CO2的曲线。
多种物质都可催化过氧化氢分解,如MnO2、CuSO4等。实验小组的同学探究漂白液(主要成分是NaClO和NaCl)、FeCl3、K2SO4能否催化过氧化氢分解。
(1)MnO2催化过氧化氢分解的化学方程式是 。
(2)如图所示,分别向三支试管中多次加入5%过氧化氢溶液,每次2mL,如有气泡产生,则将① 伸入试管,检验是否有氧气生成。结果如下表。

研究对象 |
第1次 |
第2次 |
第3次 |
第4次 |
漂白液 |
大量气泡 |
较多气泡 |
少量气泡 |
无气泡 |
FeCl3溶液 |
较多气泡 |
较多气泡 |
较多气泡 |
较多气泡 |
K2SO4溶液 |
② |
/ |
/ |
/ |
实验结论 |
ⅰ.实验中产生的气体都是氧气。(查阅得知:NaClO+H2O2═O2↑+NaCl+H2O) ⅱ.K2SO4不能催化过氧化氢分解。 ⅲ.③ 可能是过氧化氢分解的催化剂。 ⅳ.…… |
|||
(3)下列物质中,也可能是过氧化氢分解的催化剂的是 (填标号)。
A.CuCl2
B.Fe2(SO4)3
C.Na2SO4
D.KCl
(4)探究不同催化剂催化效果的实验方案:将等体积5%过氧化氢溶液加到不同催化剂中,比较用排水法收集50mL氧气的快慢。请从如图中选择合适的仪器(每种仪器限用一次),组成该探究的完整实验装置,不需要用到的是 。(填标号)。

下列图象表示的化学反应过程,与实际情况相符合的是( )
(说明:①至④对应的每组实验其他条件均相同)
| A. |
|
| B. |
|
| C. |
|
| D. |
|
下列图象与对应的叙述相符合的是( )
| A. |
|
| B. |
|
| C. |
|
| D. |
|
下列图象与对应的操作过程相符的是( )
A. 向一定量的氯化钙溶液中通入二氧化碳至过量
向一定量的氯化钙溶液中通入二氧化碳至过量
B.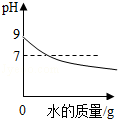 向pH=9的氨水中不断加水稀释
向pH=9的氨水中不断加水稀释
C.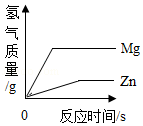 将等质量的镁片和锌片分别加入足量且溶质的质量分数相同的稀硫酸中
将等质量的镁片和锌片分别加入足量且溶质的质量分数相同的稀硫酸中
D. 用两份溶液质量和溶质的质量分数均相等的过氧化氢溶液制取氧气
用两份溶液质量和溶质的质量分数均相等的过氧化氢溶液制取氧气
过氧化氢能极缓慢分解,可看成分解为水和氧原子:H2O2→H2O+O,其水溶液显弱酸性。过氧化氢是实验室中重要化学试剂,在生产生活中有重要用途。回答下列问题:
(1)过氧化氢中氧元素的化合价为 。
(2)MnO2能加快过氧化氢分解,氧原子再结合成氧分子而制得氧气,MnO2在反应中作 剂,下列装置可用于制取氧气的是 (选填字母编号,下同),可用于收集氧气的装置有 。
(3)氧原子容易与许多有机物反应而破坏其结构,所以过氧化氢溶液能杀死新冠病毒,这个过程叫做蛋白质的 。
(4)向氢氧化钠溶液中滴加酚酞试液,再滴加过氧化氢溶液,观察到溶液先变红后褪色,猜想其褪色原因可能有两种:
①H2O2显酸性消耗了NaOH,而使红色褪去;
②H2O2分解产生的氧原子与酚酞反应破坏其结构,而使红色褪去。究竟哪种猜想合理?请用本次实验用过的试剂设计实验 (补充完实验方案)。有兴趣的同学可在后续学习中通过实验得出结论。
如图是一款变色眼镜,它的镜片内含有溴化银和氧化铜。在强光照射下,溴化银分解成单质溴和银,镜片颜色变深;当光线变暗时,溴和银在氧化铜催化作用下,又立即化合成溴化银,镜片颜色变浅。有关该眼镜的说法错误的是( )

A.塑料是高分子合成材料
B.铜螺丝久置在潮湿的空气中会产生铜锈
C.溴化银分解后,银元素的化合价升高
D.溴和银化合成溴化银前后,氧化铜化学性质不变
阅读下列材料,回答问题:
材料一:研究人员发现大气层中特别是南极上空的臭氧层日益变薄。进入大气平流层的氯氟烃(一类合成有机化合物,应用于冰箱和空调的制冷剂、灭火器等)是造成臭氧层变薄的主要原因。因为在紫外线的照射下,平流层中的臭氧存在如下平衡:O 3 O 2+O;而氯氟烃进入平流层后会分解产生氯原子(Cl),进而发生下列反应:Cl+O 3→ClO+O 2;ClO+O→Cl+O 2
研究表明:平流层中1个氯原子大约可以破坏1×10 5个臭氧分子。氯氟烃分解产生的氯原子在上述反应中起着 作用。
下列说法正确的是( )
A.由同种元素组成的物质都是单质
B.铁制品表面的铁锈能阻碍里层的铁继续锈蚀
C.浓硫酸有吸水性,在实验室中常用作某些气体的干燥剂
D.催化剂在化学反应前后,其质量和化学性质都不发生变化
下列有关催化剂的说法正确的是( )
A.在化学反应后其质量减小
B.催化剂只能加快化学反应速率
C.在化学反应后其化学性质不变
D.过氧化氢分解反应中,只能用二氧化锰作催化剂
推理是学习化学的重要方法,下列推理正确的是( )
A.有机物都含有碳元素,则含碳元素的物质一定是有机物
B.单质由同种元素组成,则由同种元素组成的纯净物一定是单质
C.中和反应有盐和水生成,则有盐和水生成的反应一定是中和反应
D.催化剂在化学反应前后质量不变,则化学反应前后质量不变的物质一定是催化剂
试题篮
()