铁、铝、铜是日常生活中使用最广泛的金属。
(1)上述三种金属中,人类最早大规模冶炼和使用的是____
(2)常温下一些金属的物理性质数据如下:
| 金属单质 |
铜 |
铝 |
锌 |
铁 |
铅 |
| 导电性(以银的导电性为100作标准) |
99 |
61 |
27 |
17 |
7.9 |
| 密度/(g·cm-3) |
8.92 |
2.70 |
7.14 |
7.86 |
11.3 |
| 熔点/℃ |
1083 |
660 |
419 |
1535 |
328 |
| 硬度(以金刚石的硬度为10作标准) |
2.5~3 |
2~2.9 |
2.5 |
4~5 |
1.5 |
分析上述数据,碎石用的大锤常用铁制而不用铝制,原因是_____________________。
(3)金属铝与氧化铁在高温条件下能发生置换反应,其化学方程式为 。
(4)炼铁的原理是利用一氧化碳与氧化铁反应。在实验室里,可用下图所示装置进行实验:实验中玻璃管内的粉末由红色变为 色,该反应的化学方程式为 。
2010年12月22日,沉没在苍茫海水中800多年的中国古沉船“南海一号”的“惊艳一浮”,让无数国人为之自豪,它既为海上丝绸之路提供了实证,又推动了中国水下考古学科的建设。据保守估计,其上载有6万至8万件文物,在已发掘出的文物中发现了大量瓷器、宋代铜钱、铁锅、梳篦等物品。
(1)中国的陶瓷举世闻名,陶瓷材料属于 材料;
(2)中国的铁锅源远流长,受到联合国卫生组织的推崇,原因之一是由于铁锅能为人体补充铁元素。若人体缺乏铁元素,容易引起 症;
(3)被发掘出的宋代铜钱已经锈迹斑斑,这是因为铜能与空气中的氧气、水以及二氧化碳发生化合反应生成铜绿[Cu2(OH)2CO3],请写出该反应的化学方程式: .
根据铜绿的组成判断,若要除去铜钱表面的铜绿,可选用的试剂为 (填化学式);
为探究铁的化学性质,小宇同学将盛有铁屑的试管塞上蓬松的棉花,然后倒置在水中。数天后,他观察到的现象是 【 】
| A.铁屑不生锈,试管内液面上升 | B.铁屑不生锈,试管内液面高度不变 |
| C.铁屑生锈,试管内液面高度不变 | D.铁屑生锈,试管内液面上升 |
物质在“潮湿的空气”中发生的变化,主要与空气中某些气体有关,下列说法不正确的是
| A.钢铁生锈与氧气、水蒸气有关 |
| B.生石灰堆放久了变质与氧气、水蒸气有关 |
| C.铜器表面生成铜绿与氧气、二氧化碳、水蒸气有关 |
| D.氢氧化钠固体潮解、变质与水蒸气、二氧化碳有关 |
炼铁厂以赤铁矿石(主要成分为Fe2O3)、焦炭、石灰石、空气等为主要原料炼铁,主要反应过程如题图所示:
请根据题图和所学知识回答相关问题:
(1)生铁属于 (填“纯净物”或“混合物”)。
(2)炼铁厂用来炼铁的主要设备是 。
(3)反应过程①②③中,属于化合反应的有 (填序号)。
(4)原料中焦炭的作用有 、
如右图所示,是实验室用CO还原氧化铁的装置, 关于该实验,下列说法错误的是( )
| A.实验时应先给玻璃管加热,后通CO |
| B.实验时,试管中澄清的石灰水变浑浊,证明该反应有二氧化碳生成 |
| C.实验中能观察到玻璃管中红棕色粉末逐渐变成黑色 |
| D.为了减少空气污染,应增加尾气处理装置 |
有下列实验,试管中的药品如图所示: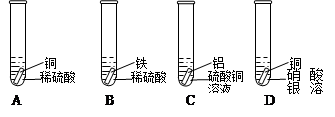
(1)上面四支试管中有气泡产生的是(填序号) ;银白色金属表面有红色物质生成的反应的化学方程式为 。
(2)从上述的实验现象中,对于铁、铜、银、铝的金属活动性强弱关系不能确定的是
(填金属的化学式)
人类对金属的开发和利用是循序渐进的。
(1)青铜器是人类较早使用的金属制品。西汉时期,人们主要采用“湿法冶金”。如将铁浸入硫酸铜溶液中,该反应的化学方程式为 。
(2)随着技术的不断进步,人们能利用还原剂从金属的氧化物中将其还原出来。例如,
高炉炼铁所涉及的物质转化过程如下:
其中,物质A为 (填化学式),A与赤铁矿中的氧化铁反应的化学方程式为 。
(3)每年因为腐蚀(如铁生锈)而报废的金属相当于年产量的20%~40%,人们采用多
种方法防止金属腐蚀。例如,将清洗后的铁锅擦干后存放可以防止铁锅生锈,其原
因是 。
(4)铝的金属活动性比铁 (填“强”或“弱”),但铝制品却具有比较好的抗腐
蚀性能,其原因是 (用化学方程式说明)。
下列铁制品在使用和保存时的注意事项,不正确的是
| A.避免长期接触潮湿空气 |
| B.用铁制品盛装食醋 |
| C.应保持铁制品表面洁净、干燥 |
| D.为防止机床生锈,在机床表面涂油 |
下列关于铁的叙述正确的是( )
| A.切过泡菜的菜刀比置于潮湿空气中的菜刀更易生锈 |
| B.铁与稀盐酸反应,生成FeCl3和H2 |
| C.能用铁桶盛装农药波尔多液 |
| D.用稀硫酸除铁锈,生成FeSO4和H2O |
现有含杂质的氧化铁样品(杂质不参加反应),为了测定该样品中氧化铁的质量分数,某同学称取样品10克,并用下图所示装置进行实验,得到以下两组实验数据.
| |
反应前 |
氧化铁完全反应后 |
| A组 |
玻璃管和氧化铁样品的质量43.7g |
玻璃管和固体物质的质量41.3g |
| B组 |
烧杯和澄清石灰水的质量180g |
烧杯和烧杯中物质的质量186.2g |
试回答:(1)你认为,应当选择 组实验数据来计算样品中氧化铁的质量分数,计算的结果为
(2)这位同学所用实验装置的不足之处是 .
人类发展的历史进程中人们不断研制出各种不同的用具,制造用具的材料也在不断地发生变化,金属制品因其美观、耐用、轻便易成型而被人们广泛利用,请根据所学知识及生活知识参与有关金属制品探究.
(1)以下工具的制作过程中没有发生化学变化的是 .
A.原始人制作石刀 B.冶炼青铜 C.炼铁
(2)请将以下金属材料的冶炼按年代的先后顺序排序 (填序号).
A.铁 B.青铜 C.铝
从以上顺序可以看出,金属制品的出现顺序与 有关,
(3)金属区别于非金属的主要物理性质是,金属具有 ,金属区别于非金属的主要化学特征是 .写出实验室最常用来制取氢气的化学方程式: .
(4)古代术士将炉甘石(主要成分为ZnCO3)与赤铜矿(Cu2O)、木炭放在炼炉中高温灼烧,炼出金光灿灿的“黄金”,被称为“炼石成金”.
①请你用学过的知识回答,真的可以“炼石成金”吗? .
(5)到西汉时期我国的劳动人民又发明了“湿法炼铜”,在西汉刘安所著的《淮南万毕术》中就有“曾青得铁则化为铜”的记载(“曾青”是指铜的化合物),请用反应方程式表示其冶炼原理: .
(6)大量有关钢铁的成语与民间谚语中.“百炼成钢”是指铁在高温条件下反复敲打的目的是降低其中 .从而了解钢与铁的机械性能不同是因为两者 .
人类的生产生活离不开金属,下列三种金属被发现、使用的先后顺序依次为:铜、铁、铝.
(1)金属大规模被使用的先后顺序跟 (填序号)选项关系最大.
①地壳中金属元素的含量;②金属的导电性;③金属的活动性.
(2)为探究锰与铁的金属活动性,在相同温度下,取大小相同、表面光亮的两种金属薄片,分别投入等体积、等溶质质量分数的足量稀盐酸中(反应中Mn显+2价),请回答:
| 金属 |
铁 |
锰 |
| 与盐酸反应现象 |
放出气泡速率缓慢 |
放出气泡速率较快 |
| 结论 |
活动性铁 < (填“>”“<”)锰 |
除了比较与酸反应产生气体速率的快慢,请你再举出一种可比较这二种金属活动性强弱的方法(写出所需药品即可): .
(3)将盛有等质量、等溶质质量分数的稀盐酸的两只烧杯,放在托盘天平左右两盘上,调节至平衡,再向两只烧杯中分别放入质量相等的镁和铁,待反应停止后,请判断:
①若天平仍保持平衡,烧杯中一定没有剩余的物质是 ;
②若天平失去平衡,则指针一定偏向放 的一边.
试题篮
()