镁元素广泛应用于火箭、导弹和飞机制造业,被称为“国防元素”。如图1所示为制取单质镁的转化过程,试回答下列问题:
如图转化过程中发生的化学反应主要有:

MgCl2+Ca(OH)2═Mg(OH)2↓+CaCl2
Mg(OH)2+2HCl═MgCl2+2H2O,MgCl2 Mg+Cl2↑
(1)在过程①中,所加石灰乳的主要成分是 (填写化学式)。
(2)过程②所发生的反应属于 (填“化合”“分解”“置换”或“复分解”)反应。
(3)下列有关过程③中能量转化的说法,正确的是 (填选项序号)。
A.电能转化为化学能 B.化学能转化为电能 C.潮汐能转化为化学能
(4)海水或卤水中本来就含有氯化镁,还需要过程①②的原因是 (选项序号)。
A.将氯化镁富集提纯 B.生成更多氯化镁 C.使石灰乳和稀盐酸反应
(5)某化学兴趣小组欲测定某氯化镁样品中MgCl2的含量(杂质为NaCl),称取10g该样品将其置于干净的烧杯中,加入适量水,使固体样品完全溶解。向所得溶液中逐滴加入溶质质量分数为10%的NaOH溶液,生成沉淀的质量与滴入NaOH溶液的质量关系如图所示。试回答下列问题:

①当滴入NaOH溶液120g时(即图中B点),烧杯中溶液里含有的溶质为 (写化学式)。
②当滴入10%的NaOH溶液80g时(即图中A点),恰好完全反应,试通过计算,求10g此氯化镁样品中MgCl2的质量。(计算结果精确至0.1g)
“丹砂(HgS)烧之成水银,积变又还成丹砂”,“以曾青(CuSO4)涂铁,铁赤色如铜”均出自西晋葛洪编写的炼丹术《抱朴子》。下列有关说法不正确的是( )
A.“丹砂(HgS)烧之成水银”水银指的是单质汞,常温下为液态
B.“以曾青(CuSO4)涂铁,铁赤色如铜”发生的化学反应为Fe+CuSO4═Cu+FeSO4
C.上述记载中涉及了四种单质;三个化学反应
D.上述记载中涉及的化学反应全部都是置换反应
镁是一种用途很广的金属,目前世界上60%的镁是从海水(溶质主要含NaCl和MgCl2等)中提取的,主要步骤如下:
(1)工业生产中,加入试剂①发生反应的化学方程式为 ,试剂②的名称为 ;
(2)写出无水MgCl2在熔融状态下电解制取金属镁的化学方程式 ,该反应属于基本反应类型中的 反应。
硅是信息技术的关键材料。从石英砂制取芯片的重要反应是SiO2+2C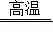 Si+2CO↑,该反应属于( )
Si+2CO↑,该反应属于( )
A.化合反应B.分解反应C.置换反应D.复分解反应
MnO2在能源、材料、信息等方面有重要应用,常用作电池的正极材料和制备金属锰等物质。在化学上,还用作催化剂和氧化剂。请回答下列问题:
(1)MnO2的制备:2KMnO4+3MnSO4+2H2O=5MnO2↓+K2SO4+2H2SO4,在反应物和生成物中,锰元素的最高化合价是 价。
(2)制备O2:加热氯酸钾和MnO2的混合物,反应的化学方程式是 。
(3)制备Cl2:MnO2+4HCl(浓) X+Cl2↑+2H2O,则X的化学式是 。
X+Cl2↑+2H2O,则X的化学式是 。
(4)Mn的冶炼:3MnO2+4Al 3Mn+2A12O3,基本反应类型是 。
3Mn+2A12O3,基本反应类型是 。
下列化学反应中,属于复分解反应的是( )
A.4Al+3O2═2Al2O3
B.Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
C.H2CO3═H2O+CO2↑
D.H2+CuO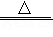 Cu+H2O
Cu+H2O
化学不仅与公民的日常生活密切相关,也是推进社会文明和科学技术进步的重要力量。
(1)"智能蒸汽熨斗"可以定时加热,自动停止,自动调控蒸汽量大小,减少了向水槽中注水的次数。从微观角度看,水槽中水逐渐减少的原因是 ,据此推测可能影响微粒运动的快慢的因素是 。
(2)我国科学家研究表明,某种虫子以塑料为食,能将聚乙烯、聚苯乙烯等降解矿化为CO 2.聚乙烯、聚苯乙烯属于 材料;昆虫降解塑料属于 变化,它可有效解决的环境问题是 。
(3)氢能是一种极具发展潜力的清洁能源。分解水制氢的一种原理如图所示:
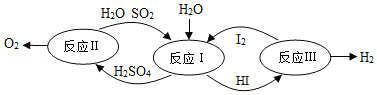
①反应I中,反应前后化合价发生改变的元素有 。
②反应Ⅲ的反应类型为 。
③理论上,每生成32gO 2能得到 gH 2。
下列化学方程式书写和对反应类型的判断,都正确的是( )
A.4Fe+3O2 2Fe2O3 化合反应
2Fe2O3 化合反应
B.Cu+2AgCl=2Ag+CuCl2 置换反应
C.SiO2+3C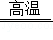 SiC+2CO↑ 置换反应
SiC+2CO↑ 置换反应
D.BaCO3+2HCl=BaCl2+H2O+CO2↑ 复分解反应
金属锰与氯化亚铁溶液可发生如下反应:Mn+FeCl2═MnCl2+Fe,下列说法错误的是( )
A.该反应属于置换反应
B.锰的金属活动性比铁强
C.锰能置换出盐酸中的氢
D.反应前后元素化合价都不变
厉害了我的国!厉害了复兴号!复兴号动车组列车(如图)是由中国铁路总公司牵头组织研制、具有完全自主知识产权、达到世界先进水平的动车组列车。
(1)列车利用碳滑板与接触网接触来获取电。碳滑板通常用石墨制成,是因为石墨具有 性;石墨在常温下,受日光照射或与空气、水分接触都不容易起变化,说明其化学性质 。
(2)制造列车的材料有:铝合金、不锈钢、高强度钢、高分子材料等。不锈钢、铝合金属于 (选填"金属材料"或"合成材料");铝合金的硬度比纯铝的硬度 ;在空气中,铝制品耐腐蚀的原因是 。
(3)列车轨道建设中常用铝和氧化铁(化学式为Fe 2O 3)在高温条件下发生反应,生成熔融状态下的铁单质对钢轨中的缝隙进行焊接。其反应的化学方程式为:Fe 2O 3+2Al 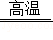 X+2Fe,则X的化学式为 ,该反应属于 (选填"置换"或"复分解")反应。
X+2Fe,则X的化学式为 ,该反应属于 (选填"置换"或"复分解")反应。

我国制碱工业先驱侯德榜发明了"侯氏制碱法",促进了世界制碱技术的发展。其主要化学反应原理如下:
NH 3+CO 2+H 2O═NH 4HCO 3 ①
NaCl+NH 4HCO 3═NaHCO 3↓+NH 4Cl ②
x NaHCO 3  Na 2CO 3+CO 2↑+H 2O ③
Na 2CO 3+CO 2↑+H 2O ③
已知NaCl、NaHCO 3和NH 4Cl在不同温度下的溶解度数据如下表:
| 温度(℃) |
0 |
10 |
20 |
30 |
40 |
|
| 溶解度/g |
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
| NaHCO 3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
|
| NH 4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
|
请回答下列问题:
(1)反应①的基本反应类型属于 反应。
(2)反应②产生的NH 4Cl在农业生产中常用作 (选填"氮肥"、"磷肥"或"钾肥")。
(3)反应③中的化学计量数x= 。
(4)20℃时,反应②中的生成物溶解度较小的是 (填化学式)
(5)20℃时,将NaCl和NaHCO 3的饱和溶液各100g,分别加热蒸发20g水,再恢复至原温度,析出晶体并得到溶液,对于所得溶液下列说法正确的是 (填序号)
A、所得溶液仍是饱和溶液
B、所得溶液的质量前者大于后者
C、所得溶液的溶质质量分数都增大
A、B、C、D表示四种物质,其反应前后的微观示意图如图。据图回答下列问题:
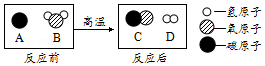
(1)四种物质中属于氧化物的是 (填字母序号)。
(2)该反应所属基本反应类型是 。
化学与生活息息相关。
(1)如图是某电子产品拆解图片。图中标示的材料属于有机合成材料的是 ;选择钛合金作为螺丝材料,是因为合金的硬度比组成金属的硬度 (填“大”或“小”)。
(2)制造电子芯片的主要材料是硅。工业上制取硅的主要化学反应为SiO2+2C Si+2CO↑,该化学反应的反应物中属于氧化物的是 ,该反应的基本类型属于 反应。
(3)生活中某些废旧电池含有汞,如果随意丢弃,会造成污染。汞的元素符号是 ,它在常温下的状态是 。常用的干电池内部填有氯化铵和二氧化锰等物质,若通过分离得到氯化铵,在实验室需进行的操作是溶解、过滤和 ,得到的氯化铵在农业上又可用作 。

从烧煤的绿皮车到利用电能的动车、高铁,火车的速度更快、能源更环保。
(1)铁路上常用铝热剂对钢轨进行焊接,发生反应的化学方程式为2Al+Fe2O3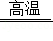 Al2O3+2Fe,该反应属于基本反应类型中的 反应,发生还原反应的物质是 (填名称)。
Al2O3+2Fe,该反应属于基本反应类型中的 反应,发生还原反应的物质是 (填名称)。
(2)绿皮车使用的煤为三大化石燃料之一,常温下呈液态的化石燃料为 。煤气化能得到更清洁的能源,煤气化的部分反应为:C+CO2 2CO、C+H2O
2CO、C+H2O H2+CO,关于上述两个反应的说法错误的是 (填序号)。
H2+CO,关于上述两个反应的说法错误的是 (填序号)。
A.都是化合反应
B.生成物都易燃
C.反应物都是单质与氧化物
试题篮
()