X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。
回答下列问题:
(1)L的元素符号为________ ;M在元素周期表中的位置为________________;五种元素的原子半径从大到小的顺序是____________________(用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为___,B的结构式为____________。
(3)硒(se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,
则Se的原子序数为_______,其最高价氧化物对应的水化物化学式为_______。
该族2~5周期元素单质分别与H2反应生成lmol气态氢化物的反应热如下,表
示生成1mol硒化氢反应热的是__________(填字母代号)。
a.+99.7 mol·L-1 b.+29.7 mol·L-1
c.-20.6 mol·L-1 d.-241.8 kJ·mol-1
X、Y、Z和W代表原子序数依次增大的四种短周期元素,X原子核内没有中子,在周期表中,Z与Y、W均相邻;Y、Z和W三种元素的原子最外层电子数之和为17。则下列有关叙述正确的是 ( )
| A.Y、Z和W三种元素可能位于同一周期 |
| B.上述元素形成的氢化物中,W的氢化物相对分子质量最大,熔沸点最高 |
| C.Y和W所形成的含氧酸均为强酸,是离子化合物 |
| D.X、Y、Z和W可以组成原子的物质的量之比为5∶1∶4∶1的离子化合物 |
[化学——物质结构与性质]尿素 可用于制有机铁肥,主要代表有
可用于制有机铁肥,主要代表有 [三硝酸六尿素合铁(III)]。
[三硝酸六尿素合铁(III)]。
(1)基态Fe3+的核外电子排布式为__________。C、N、O三种元素的第一电离能由大到小的顺序是__________。
(2)尿素分子中C、N原子的杂化方式分别是___________。
(3)  中“
中“ ”与Fe(III)之间的作用力是___________。与
”与Fe(III)之间的作用力是___________。与 互为等电子体的一种化合物是___________(写化学式)。
互为等电子体的一种化合物是___________(写化学式)。
(4)CO2和NH3是工业上制备尿素的重要原料,固态CO2(干冰)的晶胞结构如右图所示。
①1个CO2分子周围等距离且距离最近的CO2分子有__________个。
②铜金合金的晶胞结构与干冰相似,若顶点为Au、面心为Cu,则铜金合金晶体中Au与Cu原子数之比是___________。
A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是( )

A.简单离子的半径大小关系:C>E
B.D元素的气态氢化物比C元素的气态氢化物稳定
C.由A、B、C三种元素组成的离子化合物中,阴、阳离子个数比为1:1
D.由C、D、E三种元素组成的化合物,溶液显中性或碱性
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大,X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,R与Y处于同一主族,Z是短周期中金属性最强的金属元素,W的最高价氧化物对应水化物能与Z、R的最高价氧化物对应水化物均反应生成盐和水。下列说法正确的是
| A.元素Y、Z、W的简单离子具有相同的电子层结构,其半径依次增大 |
| B.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
| C.元素X与元素Y能形成两种化学键类型完全相同的化合物 |
D.元素X、Z形成化合物的电子式可以表示成 |
短周期元素A、B、C、D的原子序数依次增大,它们的原子序数之和为36,且原子最外层电子数之和为14;A、C原子的最外层电子数之和等于B原子的次外层电子数;A与C,B与D均为同主族元素。下列叙述正确的是



A.在地壳中,C元素的含量位于第一位
B.C元素位于元素周期表中的第3周期第ⅠA族
C.A、B、D三种元素形成的化合物一定是强酸
D.B元素与氢元素形成化合物的化学式一定为H2B
氯化钠是一种重要的生活、生产必需品。下列表述中正确的是
A.NaCl的电子式为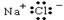 |
| B.NaCl的水溶液是强电解质 |
| C.23Na37Cl中质子数和中子数之比是8:7 |
| D.电解熔融氯化钠可得到氯气和金属钠 |
短周期元素W、X、Y、Z的原子序数依次增大,W与Y最外层电子数之和为X的最外层电子数的2倍,Z最外层电子数等于最内层电子数,X、Y、Z的简单离子的电子层结构相同,W的单质是空气中体积分数最大的气体。下列说法正确的是
| A.W的气态氢化物比X的稳定 |
| B.XY2与ZY2中的化学键类型相同 |
| C.离子半径的大小顺序:r(W)>r(X)>r(Y)>r(Z) |
| D.Y的最高价氧化物对应水化物的酸性比W的强 |
一般情况下,前者无法决定后者的是
| A.原子核外电子排布——元素在周期表中的位置 |
| B.弱电解质的相对强弱——电离平衡常数的大小 |
| C.分子间作用力的大小——分子稳定性的高低 |
| D.物质内部储存的能量一一化学反应的热效应 |
A、B、C、D、E五种常见元素的核电荷数依次增大。A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素, D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子。请回答下列问题:
(1)E的基态原子价层电子排布式为 。
(2)AB2分子中,A的杂化类型为 ;在元素周期表中A、B及与两者紧邻的元素的第一电离能由大到小的顺序为(用元素符号表示) 。
(3)B的氢化物与D的氢化物的沸点较高的是 (用化学式表示),原因是 。
(4)AB2形成的晶体的熔点 (填“高于”“低于”或“无法判断”)CD形成的晶体的熔点,原因是 .
(5)E与B形成的一种橙红色晶体晶胞结构如图所示,其化学式为 (用元素符号表示)。ED4是制取航天航空工业材料的重要原料。取上述橙红色晶体,放在电炉中,通入D2和A的单质后高温加热,可制得ED4,同时产生一种造成温室效应的气体,写出反应的化学方程式 。

(6)由C、D两元素形成的化合物组成的晶体中,晶胞结构图以及晶胞的剖面图如下图所示,若晶胞边长是acm,则该晶体的密度为 g·cm-3。(已知阿伏伽德罗常数为NA)。


A、B、C、D、E是原子序数依次增大的五种短周期元素。A原子的电子层数与它的核外电子总数相同,A与C、B与D分别为同主族元素,B和C的最外层电子数之和与E的最外层电子数相同。A与E形成的化合物化学式为AE,其分子中含18个电子。
请回答下列问题:
(1)A元素单质的化学式为______ ,D元素的原子结构示意图为______ 。
(2)由A、B、C三种元素形成的化合物的电子式为______ ,这种化合物形成的晶体 中所含的化学键类型有______ 。
(3)由A、B、D三种元素形成的一种化合物和A、B两种元素形成的一种化合物能发生氧化还原反应,反应的化学方程式:________ 。
(4)B、C、E三种元素形成一种盐,此盐中三种原子个数比为1:1:1,在25℃时,将该盐溶于水,测得溶液pH>7,理由是______ (用离子方程式表示);将该盐溶液在空气中露置一段时间后(充分光照,不考虑水分 的挥发),溶液的pH近似为7,则该过程的总反应方程式为______ 。
下表所示为部分短周期元素的原子半径及主要化合价,根据表中信息判断以下叙述正确的是
A.A、B的单质与稀盐酸反应速率B>A
B.D、E形成的简单离子的还原性E->D-
C.气态氢化物的稳定性HD<H2C
D.最高价氧化物对应的水化物的酸性 H2CO4>HEO4
五种短周期元素A、B、C、D、E,原子序数逐渐增大,A、B处于同一周期,C、D、
E同处另一周期。C、B可按原子个数比2∶l和1∶1分别形成两种离子化合物甲和乙。
A原子的最外层电子数比次外层电子层多3个。D周期序数等于D原子最外层电子数。
E原子半径是同周期中最小的(除稀有气体外)根据以上信息回答下列问题:
(1)A元素在周期表中的位置 ;
(2)乙物质中存在的化学键类型是 ;
(3)写出C与D的最高价氧化物对应的水化物相互间反应的离子方程式 ;
(4)E的单质通入C的最高价氧化物对应的水化物的溶液中反应生成的“84”消毒液的有效成分的化学式为 。
元素周期表的形式多种多样,下图是扇形元素周期表的一部分,对比中学常见元素周期表,分析其元素的填充规律,判断下列说法正确的是
| A.③元素形成的单质晶体均属于原子晶体 |
| B.④元素的气态氢化物易液化,是因为其分子间存在氢键 |
| C.②、⑦、⑧对应的简单离子半径依次减小 |
| D.②⑤⑦三种元素形成的盐溶液在25oC时的PH值为7 |
试题篮
()