1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞能发生化学反应。能引发化学反应的碰撞称之为有效碰撞。

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是_____________(选填“A”、“B”或“C”);
(2)图II是1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,则写出该反应的热化学方程式_______________________
(3)E1的大小对该反应的反应热有无影响? 。(选填“有”或“无”)
(4)进一步研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
| 化学键 |
C-H |
Cl-Cl |
C—Cl |
H—Cl |
| 键能/ kJ·mol–1 |
X |
243 |
330 |
432 |
已知:反应CH4(g)+Cl2(g)=CH3Cl(g)+HCl(g);△H= -106kJ/mol,则上表中X= 。
(5)已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH=____________________
反应3Fe(s)+4H2O(g)⇌Fe3O4(s)+4H2(g)在一体积可调的密闭容中进行,下列条件的改变对其反应速率几乎无影响的是
| A.增加Fe的表面积 |
| B.保持体积不变,充入Ne使体系压强增大 |
| C.将容器的体积缩小一半 |
| D.保持总压强不变,充入Ne使容器的体积增大 |
如图所示曲线表示其他条件一定时,反应:2NO+O2 2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2 ΔH<0,NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
| A.a点 | B.b点 |
| C.c点 | D.d点 |
羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡: CO(g)+H2S(g) COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g) K=0.1反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
| A.升高温度,H2S浓度增加,表明该反应是吸热反应 |
| B.通入CO后,正反应速率逐渐增大 |
| C.反应前H2S物质的量为7mol |
| D.CO的平衡转化率为80% |
下列说法不正确的是
| A.增大压强,活化分子百分数不变,化学反应速率增大 |
| B.升高温度,活化分子百分数增大,化学反应速率增大 |
| C.加入反应物,活化分子百分数增大,化学反应速率增大 |
| D.使用催化剂,活化分子百分数增大,化学反应速率增大 |
为探究足量锌与稀硫酸的反应速率(以v(H2)表示),向反应混合液中加入某些物质,下列判断正确的是
| A.加入NH4HSO4固体,v(H2)不变,生成H2量不变 |
| B.加入少量水,v(H2)减小,生成H2量减少 |
| C.加入CH3COONa固体,v(H2)减小,生成H2量不变 |
| D.滴加少量CuSO4溶液,v(H2)增大,生成H2量减少 |
已知反应:2NO2 (红棕色)  N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是
N2O4(无色) △H<0。将一定量的NO2充入注射器中后封口,下右图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小)。下列说法正确的是

| A.b点的操作是拉伸注射器 |
| B.d 点:v(正) < v(逆) |
| C.c点与a点相比,c(NO2)增大,c(N2O4)减小 |
| D.若不忽略体系温度变化,且没有能量损失,则温度关系:T(b)>T(c) |
在恒容密闭容器中加入一定量的反应物后存在下列平衡:
CO(g)+H2O(g) CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法正确的是
CO2(g)+H2(g),平衡时CO2物质的量浓度与温度的关系如图所示,下列说法正确的是
A.该反应的DH <0
B.在T2时,D点的反应速率:ν(正)<(逆)
C.A、C两点相比,混合气体的平均相对分子质量:M(A) < M(C)
D.若T1、T2时的平衡常数分别为K1、K2,则K1>K2
下列四种NaHCO3溶液分别加入到四个盛有10mL 2 mol·L-1盐酸的烧杯中,均加水稀释到50mL,则反应最快的是
| A.10℃20mL 3 mol·L-1的NaHCO3溶液 | B.20℃30mL 2 mol·L-1的NaHCO3溶液 |
| C.20℃10mL 4 mol·L-1的NaHCO3溶液 | D.10℃10mL 2 mol·L-1的NaHCO3溶液 |
下列说法正确的是
| A.增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 |
| B.汽车尾气的催化转化装置可将尾气中的NO和CO等有害气体快速地转化为N2和CO2,其原因是催化剂可增大NO和CO反应的活化能 |
| C.在“反应热的测量实验”中测定反应后温度的操作方法:将量筒中的NaOH溶液经玻璃棒引流缓缓倒入盛有盐酸的简易量热计中,立即盖上盖板,并用环形玻璃搅拌棒不断搅拌,准确读出并记录反应体系的最高温度 |
| D.研制性能优良的催化剂既可以提高化学反应速率,又能起到很好的节能效果 |
某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
2NH3(g)+CO2(g).实验测得不同温度下的平衡数据列于如表:
| 温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
| 平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
| 平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是___________;
A.2v(NH3)═v(CO2)
B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变
D.密闭容器中氨气的体积分数不变
②根据表中数据,列式计算25.0℃时氨基甲酸铵的分解平衡常数___________;
③取一定量的氨基甲酸铵固体放在一个带活塞的密闭真空容器中,在25℃下达到分解平衡.若在恒温下压缩容器体积,氨基甲酸铵固体的质量___________(填“增加”、“减小”或“不变”);
④氨基甲酸铵分解反应的焓变△H______0;
(2)已知:NH2COONH4+2H2O⇌NH4HCO3+NH3•H2O.该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示.
⑤计算25℃时,0~6min氨基甲酸铵水解反应的平均速率______________;
⑥根据图中信息,如何说明水解反应速率随温度升高而增大_____________________。
在一定条件下,可逆反应A+B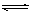 mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问:
mC变化如图所示。已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,p为反应在T2温度时达到平衡后容器加压的变化情况,问: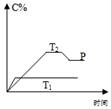
(1)温度T1 _____T2(填大于、等于或小于);
(2)正反应是__________反应(填“吸热”或“放热”);
(3)如果A、B、C均为气体,则m_____2(填大于、等于或小于);
(4)当温度和容积不变时,如向平衡体系中加入一定量的某稀有气体,则体系的压强_____(“增大”、“减小”或“不变”),平衡_______移动;当温度和压强不变时,如在平衡体系中加入一定量的某稀有气体,平衡_______移动(填“向正反应方向”“向逆反应方向”或“不”)。
已知2A2(g)+B2(g)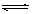 2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
2C3(g) △H=" -a" kJ•mol-1(a>0),在一个有催化剂的固定容积的容器中加入2molA2和1molB2,在500℃时充分反应达到平衡后C3的浓度为w mol/L,放出热量b kJ;
(1)比较a __________b( 填>、=、<);
(2)若将反应温度升高到700℃,反应的平衡常数将_________(增大、减小或不变);
(3)能说明该反应已经达到平衡状态的是______
a.V(C3)=2V(B2); b.容器内压强保持不变
c.V逆(A2)=2V正(B2) d.容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是_________
a.及时分离出C3气体; b.适当升高温度; c.增大B2的浓度; d.选择高效的催化剂
试题篮
()