下列装置中,都伴随有能量变化,其中是由化学能转变为电能的是
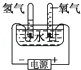
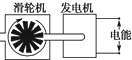


| A.电解水 | B.水力发电 | C.太阳能热水器 | D.干电池 |
短周期元素A、B、C、D在周期表中的位置如图所示:B、D最外层电子数之和为12。回答下列问题:
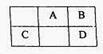
(1)与元素B、D处于同一主族的第2-5周期元素单质分别与H2反应生成1 mol气态氢化物对应的热量变化如下,其中能表示该主族第4周期元素的单质生成1 mol气态氢化物所对应的热量变化是_______(选填字母编号)。
a.吸收99.7kJ b.吸收29.7kJ c.放出20.6kJ d.放出241.8 kJ
(2)DB2通过下列工艺流程可制化工业原料H2DB4和清洁能源H2。

①查得:
| 化学键 |
H-H |
Br-Br |
H-Br |
| 键能(kJ/mol) |
436 |
194 |
362 |
试写出通常条件下电解槽中发生总反应的热化学方程式: 。
②根据资料:
| 化学式 |
Ag2SO4 |
AgBr |
| 溶解度(g) |
0.796 |
8.4×10-6 |
为检验分离器的分离效果,取分离后的H2DB4溶液于试管,向其中逐滴加入AgNO3溶液至充分反应,若观察到 ,证明分离效果较好。
③在原电池中,负极发生的反应式为 。
④在电解过程中,电解槽阴极附近溶液pH (填“变大”、“变小”或“不变”)。
⑤将该工艺流程用总反应的化学方程式表示为: 。该生产工艺的优点有 (答一点即可)。
(3)溴及其化合物广泛应用于医药、农药、纤维、塑料阻燃剂等,回答下列问题:海水提溴过程中,向浓缩的海水中通入________,将其中的Br-氧化,再用空气吹出溴;然后用碳酸钠溶液吸收溴,溴歧化为Br-和BrO3-,其离子方程式为________________ 。
(1)砷(As)与其化合物被广泛应用在农药、除草剂、杀虫剂以及含砷药物中。回答下列问题:
①砷是氮的同族元素,且比氮多2个电子层,砷在元素周期表中的位置: ;AsH3的热稳定性比NH3的热稳定性 (填“强”或“弱”)。
②As2O3俗称砒霜,As2O3是两性偏酸性氧化物,是亚砷酸(H3AsO3)的酸
酐,易溶于碱生成亚砷酸盐,写出As2O3与足量氢氧化钠溶液反应的离子
方程式 。
③As2S3和HNO3反应如下:As2S3+10H++10NO3-=2H3AsO4+3S+10NO2↑+2H2O,将该反应设计成原电池,则NO2应该在 (填“正极”或“负极”)附近逸出,该极的电极反应式为 。
(2)综合利用CO2对环境保护及能源开发意义重大。Li2O、Na2O、MgO均能吸收CO2。如果寻找吸收CO2的其他物质,下列建议合理的是 。
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
微电解法是利用原电池原理处理、净化高浓度有机废水的一种理想方法。在酸性、充入氧
气条件下的铁碳微电解法处理有机废水的过程中,有如下一些反应:
① O2+ 4H++4e-= 2H2O
② O2+ 2H2O+ 4e-= 4OH-
③ 4Fe2++O2+4H+= 2H2O+ 4Fe3+
......
下列有关这种铁碳微电解法处理有机废水说法不合理的是
| A.在处理废水的过程中,pH升高 |
| B.铁做负极,电极反应式是 Fe-2e-= Fe2+ |
| C.处理、净化过程中发生的反应都是氧化还原反应 |
| D.Fe(OH)3胶体,可净化除去废水中的悬浮物 |
某化学兴趣小组用下图所示装置进行电化学原理的实验探究,试回答下列问题:
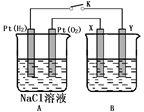
(1)通O2的Pt电极为电池 极(填电极名称);其电极方程式为 。
(2)若B电池为电镀池,目的是在某镀件上镀一层银,则X电极材料为 ;电解质溶液为 。
(3)若B电池为精炼铜,且粗铜中含有Zn、Fe、Ag、Au等杂质,则该电池阳极泥的主要成分是 。
(4)若B电池的电解质溶液为500 mL 1.0 mol/L的NaCl溶液,X、Y皆为惰性电极,当电池工作一段时间 断开电源K,Y电极有560mL(标准状况)无色气体生成(假设电极产生气体完全溢出,溶液体积不变),此时B电池溶液的pH= ;要使该溶液恢复到原来的状态,需加入(填物质并注明物质的量) 。
(5)若X、Y均是铜,电解质溶液为NaOH溶液,电池工作一段时间,X极附近生成砖红色沉淀,查阅资料得知是Cu2O,试写出该电极发生的电极反应式为 。
下列关于原电池的叙述中,正确的是
| A.原电池中,正极就是阳极,负极就是阴极 |
| B.形成原电池时,在负极上发生氧化反应 |
| C.原电池工作时,溶液中的阳离子向负极移动 |
| D.电流从负极流向正极 |
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为
| A.X>Z>Y>M | B.X>Y>Z>M | C.M>Z>X>Y | D.X>Z>M>Y |
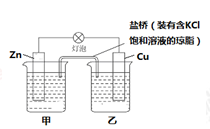
(1)已知Zn+CuSO4=Cu+ZnSO4,设计成原电池,构造如图所示,试问CuSO4溶液放在 (填“甲”或“乙”)烧杯,盐桥中的Cl-移向 (填“甲”或“乙”)烧杯;
(2)已知①C(s)+ O2(g ) = CO2(g) ΔH=-393.5kJ/mol
②CO(g)+ 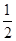 O2(g) = CO2(g) ΔH=-283.0kJ/mol
O2(g) = CO2(g) ΔH=-283.0kJ/mol
请写出C转化为CO的热化学方程式: 。
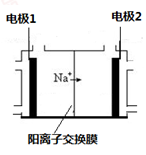
(3)电解饱和食盐水是重要的化工产业,它被称为“氯碱工业”。在教材《化学1》、《化学2》、《化学反应原理》中均有提及,请写出电解饱和食盐水的化学反应方程式 ,其中右图是《化学反应原理》中电解饱和食盐水工业中所采用的离子交换膜电解槽示意图,部分图标文字已被除去,请根据图中残留的信息(通电以后Na+的移动方向)判断电极2的名称是 ,并写出电极1的电极反应式 。
如图所示装置中,可观察到检流计指针偏转,M棒变粗,N棒变细,由此判断下表中所列M、N、P物质,其中可以成立的是

| |
M |
N |
P |
| A |
锌 |
铜 |
硫酸铜溶液 |
| B |
铜 |
锌 |
稀盐酸 |
| C |
银 |
锌 |
硝酸银溶液 |
| D |
锌 |
铁 |
硝酸铁溶液 |
某小组同学用如图所示装置研究电化学原理。下列关于该原电池的说法不正确的是
| A.原电池的总反应为Fe+Cu2+ =Fe2++Cu |
| B.盐桥中是KNO3 溶液,则盐桥中NO3-移向乙烧杯 |
| C.其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑ |
| D.反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过0.2 mol电子。 |
试题篮
()