原电池是化学对人类的一个重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图所示装置。
①a和b不连接时,烧杯中发生的离子方程式是_____________,
②a和b用导线连接,Cu极为原电池____________极(填“正”或“负”),Zn极发生__________(填“氧化”或“还原”)反应。
③Zn片上发生的电极反应:________________,Cu片上发生的电极反应:________________。
(2)若a和b相连接,导线上转移0.2mol电子时,理论上Zn片质量减轻___________g。
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
| 实验 装置 |
 |
 |
 |
 |
| 部分实验 现象 |
a极质量减小b极质量增加 |
溶液中的SO42- 向b极移动 |
d极溶解c极有气体产生 |
电流从a极流向d极 |
由此可判断这四种金属的活动性顺序是
A. a>b>c>d B. b>c>d>a C. d>a>b>c D. a>b>d>c
将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是
| A.两烧杯中铜片表面均无气泡产生 |
| B.甲中铜片是正极,乙中铜片是负极 |
| C.两烧杯中溶液的pH均增大 |
| D.产生气泡的速度甲比乙慢 |
通过NO传感器可监测NO的含量,其工作原理如图所示。下列说法错误的是
| A.该装置实现化学能向电能的转化 |
| B.该电池的总反应为2NO + O2 = 2NO2 |
| C.NiO电极的电极反应式: NO + O2- - 2e—= NO2 |
| D.当有2.24L的O2参与反应时,转移了0.4mole— |
如图所示是某乙醇燃料电池工作时的装置,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
(1)M电极的材料是______________,电极名称是______________;N极的电极反应式为___________,加入乙醇的铂电极的电极反应式为_________________。
(2)在此过程中,乙池中某一电极析出金属银4.32 g时,甲池中理论上消耗氧气____________L(标准状况下);若此时乙池溶液的体积为400 mL,则乙池中溶液的pH为____________。
(3)若在常温常压下,1 g C2H5OH燃烧生成CO2和液态H2O时放出29.71 kJ热量,表示该反应的热化学方程式为______________________。
Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为:4Li+2SOCl2 = 4LiCl+S+SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,且SOCl2能与水反应。实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解质溶液为KOH溶液。下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解质溶液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:2CH3OH + 3O2 + 4OH— 2CO32— + 6H2O,则下列说法错误的是
2CO32— + 6H2O,则下列说法错误的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应为:CH3OH-6e-+8OH- = CO32— + 6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
关于原电池和电解池的叙述正确的是
| A.原电池失去电子的电极称为阴极 |
| B.电解池的阳极、原电池的负极都发生氧化反应 |
| C.原电池的两极,一定要由活动性不同的两种金属组成 |
| D.电解时电解池的阳极一定是阴离子放电 |
分甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质。
(1)一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
CH4(g)+4NO(g)===2N2(g)+CO2(g)+2H2O(g) ΔH1
CH4(g)+4NO2(g)===4NO(g)+CO2(g)+2H2O(g)ΔH2
现有一份在相同条件下对H2的相对密度为17的NO与NO2的混合气体,用16 g甲烷气体催化还原该混合气体,恰好生成氮气、二氧化碳气体和水蒸气,共放出1042.8 kJ热量。
①该混合气体中NO和NO2的物质的量之比为____________。
②已知上述热化学方程式中ΔH1=-1160 kJ/mol,则ΔH2=____________。
③在一定条件下NO气体可以分解为NO2气体和N2气体,写出该反应的热化学方程式:______________。
(2)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛地研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:
④B极为电池____________极,电极反应式为________________。
⑤若用该燃料电池作电源,用石墨作电极电解100 mL 1 mol/L的硫酸铜溶液,当两极收集到的气体体积相等时,理论上消耗的甲烷的体积为______________(标准状况下),实际上消耗的甲烷体积(折算到标准状况)比理论上大,可能原因为________________。
X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+共存的溶液时,Y先析出;又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为
| A.X>Z>Y>M | B.X>Y>Z>M |
| C.M>Z>X>Y | D.X>Z>M>Y |
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)= Zn(OH)2(s)+Mn2O3(s),下列说法中错误的是
| A.电池工作时,锌失去电子 ,锌是负极 |
| B.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
| C.电池负极的电极反应式为:Zn-2e-+2OH—=Zn(OH)2 |
| D.电池工作时,电子由负极流向正极,溶液中OH—向正极移动,K+、H+向负极移动 |
下列关于原电池的叙述正确的是
| A.构成原电池的正极和负极必须是两种不同的金属 |
| B.原电池是将化学能转变为电能的装置 |
| C.原电池中电子流出的一极是负极,该极被还原 |
| D.原电池放电时,电流的方向是从负极到正极 |
(14分)以硫铁矿(主要成分为FeS2)为原料制取硫酸,其烧渣可用来炼铁。
(1)煅烧硫铁矿时发生反应:FeS2+O2―→Fe2O3+SO2(未配平)。当产生448 L(标准状况)SO2时,消耗O2的物质的量为____________。
(2)Fe2O3用CO还原焙烧的过程中,反应物、生成物和温度之间的关系如图所示。

(图中Ⅰ、Ⅱ、Ⅲ、Ⅳ四条曲线是四个化学反应平衡时的气相组成对温度作图得到的;A、B、C、D四个区域分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域)
已知:3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g);ΔH1=a kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g);ΔH2=b kJ·mol-1
FeO(s)+CO(g)===Fe(s)+CO2(g);ΔH3=c kJ·mol-1
① 反应Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g)的ΔH=____________kJ·mol-1(用含a、b、c的代数式表示)。
②800 ℃时,混合气体中CO2体积分数为40%时,Fe2O3用CO还原焙烧反应的化学方程式为__________________。
③ 据图分析,下列说法正确的是___________ (填字母)。
a. 温度低于570℃时,Fe2O3还原焙烧的产物中不含FeO
b. 温度越高,Fe2O3还原焙烧得到的固体物质组成中Fe元素的质量分数越高
c. Fe2O3还原焙烧过程中及时除去CO2有利于提高Fe的产率
(3) FeS2是Li/FeS2电池(示意图如图)的正极活性物质。
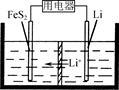
①FeSO4、Na2S2O3、S及H2O在200 ℃时以等物质的量连续反应24 h后得到FeS2。写出该反应的离子方程式: 。
②Li/FeS2电池的负极是金属Li,电解液是含锂盐的有机溶液。电池放电反应为FeS2+4Li===Fe+4Li++2S2-。该反应可认为分两步进行:第1步,FeS2+2Li===2Li++FeS22-,则第2步正极的电极反应式为____________________。
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料。甲醇在各个领域有着广泛的应用。
(1)实验测得:32 g甲醇在氧气中完全燃烧,生成二氧化碳气体和液态水时释放出726.4 kJ的热量,试写出甲醇燃烧的热化学方程式:_________________________。
(2)燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。下图是一个化学过程的示意图。2CH3OH+3O2+4KOH K2CO3+6H2O
K2CO3+6H2O

①A(石墨)电极的名称是 。
②通入O2的电极的电极反应式是________________
③写出通入CH3OH的电极的电极反应式是 。
④乙池中反应的化学方程式为 。
⑤当电路中通过0.01mol电子时,丙池溶液的C(H+) = mol/L(忽略电解过程中溶液体积的变化)。
(3)合成甲醇的主要反应是:2H2(g)+ CO(g) CH3OH(g) △H="—90.8" kJ·mol—1。
CH3OH(g) △H="—90.8" kJ·mol—1。
①在恒温恒容条件下,充入一定量的H2和CO,发生反应2H2(g)+ CO(g) CH3OH(g)。则该反应达到平衡状态的标志有
CH3OH(g)。则该反应达到平衡状态的标志有
a.混合气体的密度保持不变 b.混合气体的总压强保持不变
c.CO的质量分数保持不变 d.甲醇的浓度保持不变
e.v正(H2)= v逆(CH3OH) f.v(CO)= v(CH3OH)
②要提高反应2H2(g)+ CO(g) CH3OH(g)中CO的转化率,可以采取的措施是:
CH3OH(g)中CO的转化率,可以采取的措施是:
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2
e.加入惰性气体 f.分离出甲醇
试题篮
()