某同学的实验报告中有以下数据:①用托盘天平称取11.7g食盐;②用量筒量取5.26 mL盐酸;③用广泛pH试纸测得溶液的pH是3.5;④用标准NaOH溶液滴定未知浓度的盐酸用去23.10 mL的NaOH溶液,其中数据合理的是( )
| A.①④ | B.②③ | C.①③ | D.②④ |
某碳酸钾样品中的杂质含有纯碱、硝酸钾、硝酸钡中的一种或两种。取7.8 g该样品溶于适量水中得到澄清溶液,再加入过量CaCl2溶液得到沉淀5.0 g。下列对原样品中所含杂质的判断正确的是( )
| A.一定没有Na2CO3和Ba(NO3)2 |
| B.一定有Na2CO3而没有Ba(NO3)2 |
| C.没有Ba(NO3)2但有KNO3,可能还有Na2CO3 |
| D.没有Na2CO3但有Ba(NO3)2和KNO3 |
向某溶液中加BaCl2溶液,产生白色沉淀,加稀HNO3沉淀不消失,则溶液中( )
A.一定含有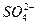 、Ag+中的一种或几种 、Ag+中的一种或几种 |
B.一定含有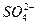 或Ag+,不含 或Ag+,不含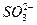 |
C.一定含有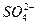 或 或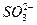 或Ag+ 或Ag+ |
D.一定含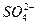 、 、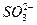 、Ag+中的一种或几种 、Ag+中的一种或几种 |
下列所述的实验操作中正确的是( )
①做完银镜反应后,试管上的附着物可用浓氨水洗涤 ②为提高高锰酸钾的氧化性,用盐酸将高锰酸钾溶液酸化 ③在容量瓶内将苛性钠溶解,以配制某浓度的氢氧化钠溶液 ④为检验集气瓶中氯气是否已充满,将润湿的淀粉碘化钾试纸置于瓶口⑤为了加快过滤的速率,用玻璃棒搅拌过滤器中的液体 ⑥中和滴定前,将滴定管用将要装入的液体润洗,锥形瓶用蒸馏水润洗
| A.②⑤ | B.④⑥ | C.①③ | D.①④ |
下列物质中既能与KMnO4溶液反应,又能与溴水反应的一组物质是( )
①苯 ②苯酚 ③甲苯 ④乙醇 ⑤乙烯 ⑥乙烷⑦亚硫酸
| A.②③⑤⑥ | B.②④⑥⑦ | C.②⑤⑦ | D.全部 |
如下图中①—11分别代表有关反应物中的一种物质,请填写以下空白。
(1)①③④的化学式分别是___________、___________、___________。
(2)⑧与⑨反应的化学方程式是________________________________________________。
(3)②与Mg条(点燃)反应的化学方程式为:__________________________________。
市售家用消毒液发生器是化学知识在日常生活中的“创新”应用。该发生器利用常见的精盐和自来水为反应物。通电时,器中电解槽内的极板上产生大量气泡;切断电源后所得消毒液具有强烈的杀菌能力,且对人体无毒,跟该发生器直接有关的化学反应是( )
A.2NaCl+2H2O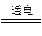 2NaOH+H2↑+Cl2↑ 2NaOH+H2↑+Cl2↑ |
| B.H2+Cl2====2HCl |
| C.Cl2+2NaOH====NaClO+NaCl+H2O |
D.Cl2+H2O HCl+HClO HCl+HClO |
(12分)某兴趣小组在研究性学习中设计了如下实验来探究Fe与H2SO4反应的过程,装置如下图所示。实验步骤:①在烧瓶中加入80% H2SO4;②将提拉式铁丝插入溶液中,观察到先有少量气泡,后停止的现象;③加热烧瓶至有较多量气体产生时停止加热,品红试液颜色褪去烧瓶中溶液变为棕黄色。④一段时间后KMnO4/H+颜色不再变浅,但NaOH溶液中仍有气泡逸出,在导管口处可以点燃该气体。烧瓶中液体变为浅绿色。根据以上实验回答:
(1)在步骤②中现象说明 ;
(2)在步骤③中,品红褪色的原因是 ;
(3)写出步骤④中,使溶液变为浅绿色的可能原因(用离子方程式表示) ; ;
(4)设计实验证明反应后的溶液中有Fe2+: 。
某同学为了探究该校化学实验室的一种黑色粉末和一瓶标签破损的无色溶液,可能是什么物质,大胆猜想并设计实验进行验证。
[发现问题]当把黑色粉末与无色溶液混合时即产生气泡。[查阅资料]中学化学实验室常见的黑色粉末有氧化铜、二氧化锰、四氧化三铁、铁粉、炭粉等。
[提出假设]黑色粉末是 ,无色溶液是 。(只写一种假设)
[设计实验]
| 实验操作 |
实验现象 |
实验结论 |
| |
|
|
中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:


 图1 图2
图1 图2 ①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。 ②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。 回答下列问题:
回答下列问题: (1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ; (2)塑料袋作用是: ;
(2)塑料袋作用是: ; (3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。

稀薄燃烧是指汽油在较大空气/燃比(空气与燃油气的体积比)条件
下的燃烧。随着全球能源危机的加剧,稀薄燃烧技术的研究受到了人们的
重视,但稀薄燃烧时,常用的汽车尾气净化装置不能有效地将NOx转化为
N2。不同空/燃比时汽车尾气中主要污染物的含量变化如图所示。
(1)稀薄燃烧技术除能节约能源外,还具有的优点是 (填一项)。排放到大气中的NOx会导致酸雨、 等环境问题(填一项)。
(2)某校化学研究性学习小组的同学在技术人员的指导下,按下列流程探究不同催化剂对NH3还原NO反应的催化性能。







若控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入滴有酚酞的稀硫酸溶液(溶液的体积、浓度均相同)。为比较不同催化剂的催化性能,
需要测量并记录的数据是 。
(3)若某一催化剂能同时催化NH3等还原性气体与NOx的反应。将该催化剂分别用于催化还原含等物质的量NOx的两种气体:①纯NO气体,②汽车尾气。消耗NH3的物质的量较多的可能是 (填字母),原因是 。
A.① B.② C.都有可能
某研究小组进行与NH3有关的系列实验。
(1)从下图中挑选所需仪器,画出制取干燥NH3的装置简图(添加必要的塞子、玻璃导管、胶皮管。固定装置和尾气处理装置不用画),并标明所用试剂。
(2)将NH3通入溴水中,有N2生成,反应的化学方程式为 。
某兴趣小组设计出右图所示装置来改进教材中"铜与硝酸反应"实验,以探究化学实验的绿色化。

(1)实验前,关闭活塞,试管
中加水至浸没长导管口,塞紧试管
和
的胶塞,加热
。其目的是。
(2)在中加适量
溶液,
中放一小块铜片,由分液漏斗
向
中加入2
浓硝酸。
中反应的化学方程式是。再由
向
中加2 mL蒸馏水,
中的实验现象是。
| 方案 |
反应物 |
| 甲 |
|
| 乙 |
|
| 丙 |
(3)右表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是。理由是。
(4)该小组还用上述装置进行实验证明氧化性。操作步骤为,实验现象为;但此实验的不足之处是。
水中氧的含量测定步骤如下:
步骤1:水中的氧在碱性溶液中将Mn2+氧化为MnO(OH)2。
步骤2:加入碘离子将生成的MnO(OH)2再还原成Mn2+离子。
步骤3:用硫代硫酸钠标准溶液滴定步骤2中生成的碘。
有关的测定数据如下:
1:Na2S2O3溶液的标定。取25.00 mL KIO3标准溶液(KIO3浓度:174.8 mg·L-1)与过量KI在酸性介质中反应,用Na2S2O3溶液滴定,消耗12.45 mL。
2:取20.0°C下新鲜水样103.5mL,按上述测定步骤滴定,消耗Na2S2O3标准溶液11.80 mL。已知该温度下水的饱和O2含量为9.08 mg·L-1。
3.在20.0°C下密闭放置5天的水样102.2 mL,按上述测定步骤滴定,消耗硫代硫酸钠标准溶液6.75 mL。
5-1 写出上面3步所涉及的化学反应方程式。
5-2 计算标准溶液的浓度(单位mol·L-1)。
5-3 计算新鲜水样中氧的含量(单位mg·L-1)。
5-4 计算陈放水样中氧的含量(单位mg·L-1)。
5-5 以上测定结果说明水样具有什么性质?
试题篮
()