一定条件下,反应N2(g)+3H2(g) 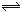 2NH3(g)在10L的密闭容器中进行,测得2min内N2的物质的量由20mol减小到8mol,则2min内用NH3表示的反应速率为
2NH3(g)在10L的密闭容器中进行,测得2min内N2的物质的量由20mol减小到8mol,则2min内用NH3表示的反应速率为
| A.1.2mol/(L·min) | B.6.0mol/(L·min) |
| C.0.6mol/(L·min) | D.0.4mol/(L·min) |
为了更好地利用资源,我们应该“珍惜地球资源,转变发展方式”。下列行为不符合该主题的是
| A.开发太阳能、氢能、风能等新能源 |
| B.应用高效洁净的能源转化技术 |
| C.更新采煤、采油技术,提高产量以满足工业生产的快速发展 |
| D.减少资源消耗,增加资源的重复使用、资源的循环再生 |
某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图(夹持仪器略):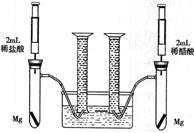
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为____________________。
(2)在上述实验方案中有一明显欠缺,该欠缺是____________。
(3)在欠缺已经得到改正的方案下,反应起始时,产生氢气的速率关系应是____________;最终产生氢气体积的关系应是_______________。
(4)实验中产生的氢气体积比理论值高,可能原因是_______________________。
(5)通过比较起始反应的速率可以得出的结论是______________。
(6)除上述方法外,还可以通过其他方向比较盐酸和醋酸的酸性,请写出其中的一种方法_________。
电解CuCl2溶液时,如果阴极上有1.6g铜析出,则阳极上产生气体的体积(标准状况)约为( )
| A.0.28 L | B.0.56 L | C.0.14 L | D.11.2 L |
铜板上铁铆钉长期暴露在潮湿的空气中,形成一层酸性水膜后铁铆钉会被腐蚀,示意图如下。下列说法不正确的是
| A.因铁的金属性比铜强,所以铁铆钉被氧化而腐蚀 |
| B.若水膜中溶解了SO2,则铁铆钉腐蚀的速率变小 |
| C.铜极上的反应是2H+ + 2e- = H2↑,O2 + 4e-+ 4H+ = 2H2O |
| D.在金属表面涂一层油脂,能防止铁铆钉被腐蚀 |
化学与人类生产、生活、环境保护及社会可持续发展密切相关,下列有关叙述正确的是( )
| A.绿色化学的核心是应用化学原理对环境污染进行治理 |
| B.PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 |
| C.二氧化硅广泛应用于太阳能电池、计算机芯片 |
| D.汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
下列各组物质中,属于同分异构体的是( )
A. 和 和  |
| B.H2N-CH2-COOH 和 H3C-CH2-NO2 |
| C.CH3-CH2-CH2-COOH 和 H3C-CH2-CH2-CH2-COOH |
D.H3C-CH2-O-CH2-CH3 和  |
有机物 的正确命名为
的正确命名为
| A.2-乙基-3,3-二甲基-4-乙基戊烷 |
| B.3,3-二甲基-4-乙基戊烷 |
| C.3,3,4-三甲基已烷 |
| D.2,3,3-三甲基已烷 |
金属镍有广泛的用途。粗镍中含有少量杂质Fe、Zn、Cu、Pt,可用电解法制备高纯度的镍(已知:氧化性Fe2+<Ni2+<Cu2+),下列叙述正确的是( )。
| A.阳极发生还原反应,其电极反应式:Ni2++2e-=Ni |
| B.电解过程中,阳极质量的减少与阴极质量的增加相等 |
| C.电解后,溶液中存在的阳离子只有Fe2+和Zn2+ |
| D.电解后,电解槽底部的阳极泥中只有Cu和Pt |
据报道,我国拥有完全自主产权的氢氧燃料电池车将在北京奥运会期间为运动员提供服务。某种氢氧燃料电池的电解液为KOH溶液,下列有关该电池的叙述不正确的是
| A.正极反应式为:O2+2H2O+4e-=4OH- |
| B.工作一段时间后,电解液中KOH的物质的量不变 |
| C.该燃料电池的总反应方程式为:2H2+O2=2H2O |
| D.用该电池电解CuCl2溶液,产生2.24 L Cl2(标准状况)时,有0.1 mol电子转移 |
下列关于钢铁锈蚀的叙述中,错误的是( )
| A.酸雨能使钢铁更容易发生电化学腐蚀 |
| B.钢铁在潮湿的地窑中较易发生析氢腐蚀 |
| C.铁锈的主要成分是Fe2O3·nH2O |
| D.钢铁锈蚀时,铁原子失去电子成为Fe3+,而后生成Fe(OH)3,再部分脱水成为氧化铁的水合物 |
试题篮
()