反应4A(g)+5B(s)═4C(g)+6D(g)在0.5L密闭容器中进行,30s内A减少了0.90mol,则此反应的速率可表示为
A.v(B)=0.075mol/(L•s) B.v(A)=0.030mol/(L•s)
C.v(C)=0.040mol/(L•s) D.v(D)=0.090mol/(L•s)
(火箭推进器常以联氨(N2H4) 为燃料、过氧化氢为助燃剂.已知下列各物质反应的热化学方程式:N2H4(g)+O2(g)═N2(g)+2H2O(g)△H1=﹣533.23kJ•mol﹣1
H2O(g)═H2O (l)△H2=﹣44kJ•mol﹣1
2H2O2(l)═2H2O(l)+O2(g)△H3=﹣196.4kJ•mol﹣1
则联氨与过氧化氢反应的热化学方程式可表示为
| A.N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H="+817.63" kJ•mol﹣1 |
| B.N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.63 kJ•mol﹣1 |
| C.N2H4(g)+2H2O2(l)═N2(g)+4H2O(l)△H=﹣641.63 kJ•mol﹣1 |
| D.N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣817.63 kJ•mol﹣1 |
生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
| 化学键 |
N≡N |
F﹣F |
N﹣F |
| 键能/KJ•mol﹣1 |
941.7 |
154.8 |
283.0 |
下列说法中正确的是
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的△H>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
反应A(g)+2B(g)=C(g)的反应过程中能量变化如图所示.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是
| A.该反应是吸热反应 |
| B.催化剂改变了该反应的焓变 |
| C.催化剂降低了该反应的活化能 |
| D.该反应的焓变△H=﹣510kJ.mo1﹣1 |
下列说法或表示法正确的是
| A.氢气与氧气反应生成等量的水蒸气和液态水,前者放出热量多 |
| B.需要加热的反应说明它是吸热反应 |
| C.在稀溶液中:H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3 kJ/mol,若将含0.5 mol H2SO4的稀硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ |
| D.1 mol S完全燃烧放热297.3 kJ,其热化学方程式为:S+O2═SO2△H=﹣297.3 kJ/mol |
在如图所示的一些常见单质,化合物等物质之间的转化关系中(有些反应过程中的水,部分产物和反应条件未全部列出),已知反应①是氯碱工业的最基础的反应,A、B、F、H、J的焰色反应均为黄色,热的F溶液可以去除物品表面的油污,I为地壳中含量最多的金属元素的单质,L是典型的两性氧化物,在常温常压下C、D、G均为气体,D呈黄绿色,G是形成温室效应的主要气体.
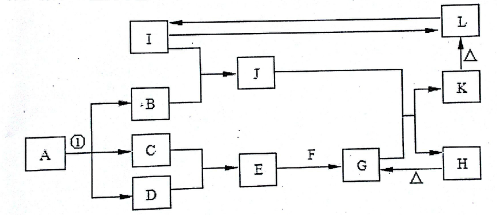
(1)反应①进行的条件为 .
(2)化合物F的化学式为 .
(3)I与氧化铁反应的化学方程式为 .
(4)J的水溶液与G反应生成K和H的离子方程式为 .
向500mL bmol/L稀硝酸中加入等物质的量的铁粉和铜粉的混合物18g,充分反应(设HNO3只被还原成NO).下列有关该反应的判断正确的是
| A.若铜有剩余,则向反应后的溶液中再滴加硫酸,铜也不能溶解 |
| B.若金属全部溶解,则反应后的溶液中一定含有Cu2+、Fe3+离子 |
| C.若铁粉全部转化为Fe2+离子,则b的值为0.8 |
| D.若反应后的溶液中n(Fe3+):n(Fe2+)=3:2,则产生的NO为5152 mL(标准状况) |
下列除去有关物质中杂质的方案中,正确的是
| 选项 |
物质(括号内为杂质) |
除去杂质使用的试剂 |
除去杂质的方法 |
| A |
Cl2气(HCl气) |
NaOH溶液,浓硫酸 |
洗气 |
| B |
NH4Cl溶液(FeCl3) |
NaOH溶液 |
过滤 |
| C |
Na2CO3固体(NaHCO3) |
﹣﹣﹣﹣ |
灼烧 |
| D |
I2 (H2O) |
CCl4 |
蒸馏 |
A.A B.B C.C D.D
用NA表示阿伏加德罗常数的值.下列说法正确的是
| A.常温常压下,l1.2 LHCl中含有的分子数目为0.5NA |
| B.NA个氢分子和NA个氧分子的质量比为1:16 |
| C.标准状况下,22.4 L水中含有的分子数目为NA |
| D.1 molCl2与足量的铁反应转移的电子数目是NA |
某溶液中含有大量的NH4+、C1﹣、Ca2+,在该溶液中还可能大量存在的离子是
| A.CO32﹣ | B.OH﹣ | C.Al3+ | D.Ag+ |
下列甲、乙、丙、丁所示的装置或操作能达到实验目的是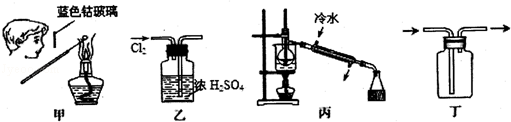
| A.用甲所示的装置与操作检验某物质中K+的存在 |
| B.用乙所示的装置除去氯气中的少量H2O |
| C.用丙所示的装置分离酒精与水 |
| D.用丁所示的装置收集NO |
为除去铜粉中混有的少量铝粉,下列试剂不可行的是
| A.CuCl2溶液 | B.稀硝酸 | C.NaOH溶液 | D.稀盐酸 |
下列电离方程式书写正确的是
| A.Na3PO4═3Na++P5++4O2﹣ | B.H2SO4═H++SO42﹣ |
| C.NH3•H2O⇌NH4++O2﹣+H+ | D.NH4NO3═NH4++NO3﹣ |
下列变化过程中,没有发生化学变化的是
| A.铝的钝化 | B.光合作用 | C.碘的升华 | D.海水提溴 |
试题篮
()