某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、CO32-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化的图像如图所示,下列说法正确的是( )

| A.原溶液中含有的阳离子是H+、NH4+、Mg2+、Al3+ |
| B.原溶液中一定含有SO42-和Na+ |
| C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
| D.反应最后形成的溶液中含有的溶质只有Na2SO4 |
电化学原理在能量转换、物质合成、防止金属腐蚀等方面应用广泛。
I.下列是常见的电化学示意图
(1)图①是碱性锌锰电池的构造示意图,在正极反应的物质是_______________(填“Zn”或“MnO2”),正极发生_______反应(填“氧化”或“还原”)。
(2)图②是酸性电解质的氢氧燃料电池工作原理示意图,B极发生的电极反应是________________。
(3)图③表示钢铁发生吸氧腐蚀生锈的示意图,写出氧气发生的电极反应:___________________。
(4)能表示“牺牲阳极的阴极保护法”的示意图是______________(填序号)。图④中,钢闸门连接电源的_____________极而受到保护。在图⑤中标出电子的移动方向。
II.下列是常见的电化学装置图。
(5)图⑥中电池的总反应为__________________(写化学方程式),盐桥中装有含琼胶的KCl饱和溶液,盐桥中Cl-会向_______________(填“左”或“右”)边烧杯中的溶液移动。
(6)检验图⑦中阳极产物的方法和现象是________________。
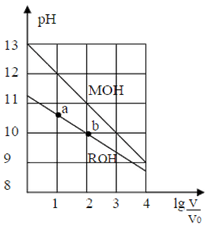
室温下,浓度均为0.10mol/L,体积均为V0的MOH和ROH溶液,分别加水稀释至体积V,pH随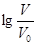 的变化如图所示。下列叙述正确的是( )
的变化如图所示。下列叙述正确的是( )
| A.稀释前两溶液的Ka:MOH溶液>ROH溶液 |
| B.ROH的电离程度:b点小于a点 |
| C.两溶液在稀释过程中,c(H+)均逐渐减少 |
D.当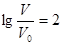 时,若两溶液同时升高温度,则 时,若两溶液同时升高温度,则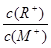 增大 增大 |
将20g某铁矿石(设只含铁的氧化物和杂质SiO2)溶于过量的稀盐酸,过滤后得5.6g不溶物和滤液;然后在滤液中加入足量的NaOH溶液,过滤后将沉淀灼烧,得16g红棕色固体。
(1)红棕色固体的化学式是 ,其中的n(Fe)= mol。
(2)请计算(写出计算过程):
①该矿石中铁氧化物的化学式。
②若加入的稀盐酸为4.0mol·L -1200mL,反应前后体积变化忽略不计,则滤液中剩余H+的物质的量浓度是多少?
硅酸钠被国家列为“我国优先发展的精细化学品”和“今后我国无机化工产品发展重点”之一。下图是用海边的石英砂(含氯化钠、氧化铁等杂质)制备硅酸钠的工艺流程示意简图:
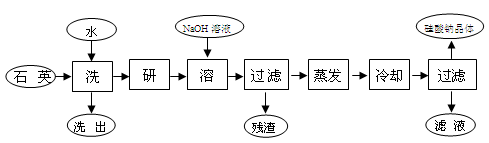
(1)要将洗出液中的溶质析出,采用的方法是 (填:“蒸发”、“降温”)结晶;蒸发时用到的硅酸盐仪器有 、 、 。
(2)上述流程中加入NaOH溶液,反应的离子方程式为 。
(3)用上述残渣中的氧化铁焊接铁轨,其铝热反应的化学方程式为(并在方程式中用“单线桥”标出电子转移方向和数目) 。
为了验证木炭可被浓H2SO4氧化成CO2,选用下图所示仪器 (内含物质)组装成实验装置[已知:酸性H2SO3>H2CO3,Ca(HSO3)2溶于水]:
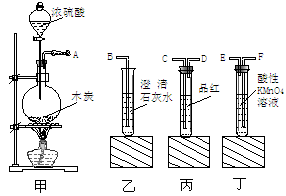
(1)甲中反应的化学方程式为: 。
(2)如按气流由左向右流向,连接上述装置的正确顺序是(填各接口字母): 接 , 接 , 接 。
(3)要检验出CO2,实验现象是:乙中 ,丙中 。
(4)丁中酸性KMnO4溶液的作用是 ;丙中品红的作用是 。
将一定质量的铜粉加入到100 mL某浓度的稀硝酸中,充分反应后,容器中剩有m1 g铜粉,此时共收集到NO气体560 mL(标准状况).然后向上述混合物中加入足量稀硫酸至不再反应为止,容器仍剩有铜粉m2 g,则(m1-m2)为
| A.7.2 | B.2.4 |
| C.0 | D.缺少条件,无法计算 |
1000 mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
| 阳离子 |
K+、NH4+、Fe3+、Ba2+ |
| 阴离子 |
Cl-、Br-、CO32-、 HCO3-、SO32-、SO42- |
现进行如下实验操作(每次实验所加试剂均过量):
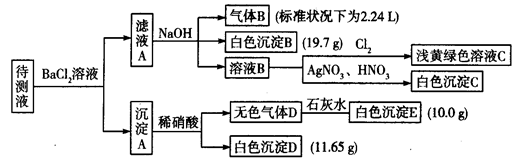
(1)写出生成白色沉淀B的离子方程式:__________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
| 阴离子 |
Cl- |
Br- |
CO32- |
HCO3- |
SO32- |
SO42- |
| 浓度/mol·L-1 |
|
|
|
|
|
|
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:_________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能与稀硝酸反应的成分是______________________________(写化学式)。
可降解聚合物P的制取路线如下

iii. (还原)其中-NH2基团可以在一定条件下生成-OH基团
(还原)其中-NH2基团可以在一定条件下生成-OH基团
(1)A的含氧官能团名称是_______________。
(2)羧酸a的电离方程是________________。
(3)B→C的化学方程式是________________。
(4)化合物D苯环上的一氯代物有2种,D的结构简式是 。
(5)E→F中反应①和②的反应类型分别是______________、_______________。
(6)F的结构简式是______________。
(7)聚合物P的结构简式是 。
我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,下图是某化工厂对海水资源综合利用的示意图:
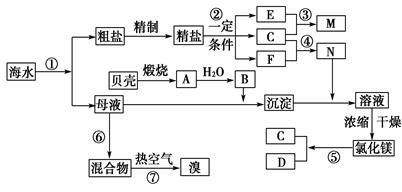
Ⅰ.(1)写出N的化学式_________________________;
(2)写出反应②的化学方程式_________________________。
Ⅱ.粗盐中含有Ca2+、Mg2+、
SO42-等杂质,精制时所用的
试剂为:①盐酸 ②氯化钡溶液
③氢氧化钠溶液 ④碳酸钠溶液,以上试剂添加的顺序可以为____________。
A.②③④① B.③④②① C.④③②① D.③②④①
Ⅲ.提取粗盐后剩余的海水(母液)中,可用来提取Mg和Br2。
(1)若用来提取Mg,根据上述提取Mg的流程,没有涉及到的反应类型是____________。
A.分解反应 B.化合反应 C.置换反应 D.复分解反应
(2)若用来提取Br2,反应⑥所用的气态氧化剂的寻找货源的设想,其中合理的是____________。
A.从外地购买 B.在当地新建生产厂
C.从本厂生产烧碱处循环 D.从本厂生产镁单质处循环
(3)母液用来提取Mg和Br2先后顺序,甲乙两位工程师有不同观点:
甲:母液先提取Mg,后提取Br2 乙:母液先提取Br2,后提取Mg
请你判断哪个更合适?______(填“甲”或“乙),理由是____________________________ ___。
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: (两个);不采用铜跟浓硫酸反应来制取硫酸铜的原因是 (答两点)
(2)在一定体积的10 mol·L-1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9 mol。则浓硫酸的实际体积 (填“大于”、“等于”或“小于”)180 mL。
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为
(4)将8 g Fe2O3投入到150 mL某浓度的稀硫酸中,再投入7 g铁粉,充分反应后,收集到1.68 L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4 mol·L-1的NaOH溶液150 mL。则原硫酸的物质的量浓度为
现有金属单质A、B、C、D和气体甲、乙、丙及物质E、F、G、H、I,它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
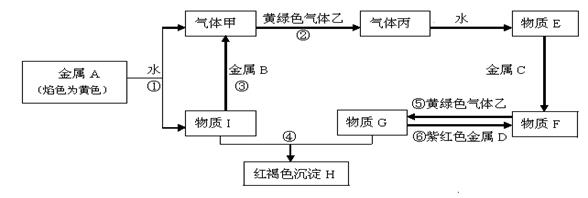
请根据以上信息回答下列问题:
(1)写出下列物质的化学式: B ;F ;H ;
(2)写出反应①的离子方程式:
写出反应⑥的离子方程式: ;
(3)气体乙与SO2气体都具有漂白性,将等体积的气体乙和SO2通入到水中,得到的溶液是否具有漂白性?_______________(填“是”或“否”).反应的化学方程式:
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、NO的混合气体,这些气体与1.68LO2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入4mol·mol-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60mL | B.45mL | C.30mL | D.75mL |
将9.58 g Na2CO3·10H2O与NaHCO3的混合物溶于水配成100mL溶液,测得c(Na+)="1" mol/L。再取同质量的混合物,加入足量的盐酸 ,充分加热蒸干至质量不变时,所得固体的质量为: ( )
| A.5.30g | B.7.78g | C.6.72g | D.6g |
甲醇是重要的化工原料,在工业生产上的应用十分广泛。
(1)利用太阳能或生物质能分解水制H2,然后可将H2与CO2转化为甲醇。
已知:光催化制氢:2H2O(l)==2H2(g)+O2(g) ΔH=+571.5 kJ/mol
H2与CO2耦合反应:3H2(g)+CO2(g)==CH3OH(l)+H2O(l) ΔH=-137.8 kJ/mol
则反应:2H2O(l)+CO2(g) ="=" CH3OH(l)+3/2O2(g)的ΔH= kJ/mol
你认为该方法需要解决的技术问题有 。
a. 开发高效光催化剂
b. 将光催化制取的H2从反应体系中有效分离,并与CO2耦合催化转化
c. 二氧化碳及水资源的来源供应
(2)工业上由甲醇制取甲醛的两种方法如下(有关数据均为在298 K时测定):
反应I:CH3OH(g)=HCHO(g)+H2(g) ΔH1=+92.09kJ/mol,K1=3.92×10-11。
反应II:CH3OH(g)+1/2O2(g)=HCHO(g)+H2O(g) ΔH2=-149.73 kJ/mol,K2=4.35×1029。
①从原子利用率看,反应(填“I”或“II”。下同)制甲醛的原子利用率更高 。从反应的焓变和平衡常数K值看,反应 制甲醛更有利。(原子利用率表示目标产物的质量与生成物总质量之比。)
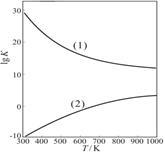
②右图是甲醇制甲醛有关反应的lgK(平衡常数的对数值)随温度T的变化。图中曲线(1)表示 (填“I”或“II”)的反应 。
(3)污水中的含氮化合物,通常先用生物膜脱氮工艺进行处理,在硝化细菌的作用下将NH4+氧化为
NO3-(2NH4++3O2=2HNO2+2H2O +2H+;2HNO2 +O2=2HNO3)。然后加入甲醇,甲醇和NO3-反应转化为两种无毒气体。
①上述方法中,1 g铵态氮元素转化为硝态氮元素时需氧的质量为 g。
②写出加入甲醇后反应的离子方程式:
(4)某溶液中发生反应:A 2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是
2B+C,A的反应速率v(A)与时间t的图象如图所示。若溶液的体积为2L,且起始时只加入A物质,下列说法错误的是

A.图中阴影部分的面积表示0~2min内A的物质的量浓度的减小值
B.反应开始的前2min,A的平均反应速率小于0.375mol・L-1・min-1
C.至2min时,A的物质的量减小值介于0.5mol至1mol之间
D.至2min时,B的物质的量浓度c(B)介于1~1.5mol・L-1之间
试题篮
()