乙酰基二茂铁是常用的汽油的抗震剂,由二茂铁合成乙酰基二茂铁的原理如下:

其实验步骤如下:
步骤1:如图Ⅰ所示,取1 g二茂铁与3 mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1 mL,加热回流5 min。
步骤2:待反应液冷却后,倒入烧杯中加入10 g碎冰,搅拌至冰全部融化,缓慢滴加NaHCO3溶液中和至中性,置于冰水浴中15 min。抽滤,烘干,得到乙酰基二茂铁粗产品。
步骤3:将乙酰基二茂铁粗产品溶解在苯中,从图Ⅱ装置的分液漏斗中滴下,再用乙醚淋洗。
步骤4:将其中一段时间的淋洗液收集,并进行操作X,得到纯净的针状晶体乙酰基二茂铁并回收乙醚。
(1)步骤2中的抽滤操作,除烧杯、玻璃棒外,还必须使用属于硅酸盐材质的仪器有 。
(2)步骤2中不需要测定溶液的pH就可以判断溶液接近中性,其现象是 。
(3)步骤3将粗产品中杂质分离实验的原理是 。
(4)步骤4中操作X的名称是 ,该操作中不能使用明火的原因是 。
(5)为确定产品乙酰基二茂铁中是否含有杂质二乙酰基二茂铁( ),可以使用的仪器分析方法是 。
),可以使用的仪器分析方法是 。
苯酚具有弱酸性,在空气中易被氧化。工业上以苯、硫酸、氢氧化钠、亚硫酸钠为原料合成苯酚的方法可简单表示为:
(1)根据上述反应判断下列三种物质的酸性由强到弱的顺序为 (填序号)。
A. B.
B. C.H2SO3
C.H2SO3
(2)步骤④与使用CO2相比,使用SO2的优点是 (答一个方面)。
(3)经反应④得到的产物除 外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在
外、可能还含有OH-、SO32-、HSO3-等微粒。请设计实验方案,证明溶液中存在 、SO32-、HSO3-,写出实验步骤、预期现象和结论。
、SO32-、HSO3-,写出实验步骤、预期现象和结论。
限选仪器及试剂:试管、滴管、玻璃棒、过滤装置和滤纸;2mol·L-1盐酸、1mol·L-1 BaCl2溶液、品红溶液、0.01 mol·L-1酸性KMnO4溶液、1 mol·L-1 FeCl3溶液、饱和溴水等。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量待测液于试管中,加入足量的1 mol·L-1BaCl2溶液,静置、过滤,得滤液和沉淀。将滤液分置于试管A、B中,沉淀置于试管C中。 |
 |
| 步骤2:往试管A中加入 。 |
,说明溶液中含有HSO3-。 |
| 步骤3:往试管B中加入 。 |
。 |
| 步骤4:往试管C中加入2 mol·L-1盐酸酸化,再滴入1~2滴品红溶液。 |
,说明溶液中含有SO32-。 |
(4)纯度测定:称取1.00g产品溶解于足量温水中,向其中加入足量饱和溴水(产品中除苯酚外,不含其它与饱和溴水反应生成沉淀的物质),苯酚全部生成三溴苯酚沉淀,经过滤、洗涤、干燥后,称得沉淀质量为3.31g,则产品中苯酚的质量分数为 。(苯酚的分子式为C6H6O,三溴苯酚的分子式为C6H3Br3O,它们的相对分子质量分别为94、331)
1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm ,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
(1)写出制备1,2-二溴乙烷的化学方程式________。
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c中导管是否发生堵塞。如果发生堵塞,a中的现象是__________。
(3)容器b中NaOH溶液的作用是__________,容器d中NaOH溶液的作用是__________。
(4)试管c浸入冷水中,以及液溴表面覆盖少量水的原因是__________。
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因________________.
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| ⑴称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: ⑴A的相对分子质量为: 。 |
| ⑵将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g |
⑵A的分子式为: 。 |
| ⑶另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) |
⑶A中官能团的结构简式: 、 。 |
⑷A的核磁共振氢谱如下图: |
⑷A中含有 种氢原子 |
| ⑸综上所述,A的结构简式 。A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式 。 |
某课外小组设计的实验室制取乙酸乙酯的装置如图所示,A中放有浓硫酸,B中放有乙醇、无水醋酸钠,D中放有饱和碳酸钠溶液。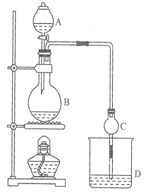
已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH
②有关有机物的沸点:
| 试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
| 沸点/℃ |
34.7 |
78.5 |
118 |
77.1 |
请回答:
(1)浓硫酸的作用:________________;若用同位素18O示踪法确定反应产物水分子中氧原子的提供者,写出能表示18O位置的化学方程式:
(2)球形干燥管C的作用是 反应前向D中加入几滴酚酞,反应结束后D中的现象是 。
(3)从D中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出____________;再加入(此空从下列选项中选择)_________;然后进行蒸馏,收集77℃左右的馏分,以得到较纯净的乙酸乙酯:
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使KMnO4酸性溶液褪色.其蒸气密度是相同状况下甲烷密度的7.5倍.在溴化铁存在时与溴反应,能生成两种一溴代物.该有机物可能是 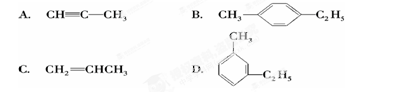
有①甲烷,②乙烷,③丙烷,④丁烷4种烷烃,试回答下列问题:
(1)请写出烷烃(用通式表示)在足量的氧气中充分燃烧的化学方程式:
________________________________________________________________________。
(2)相同状况下,等体积的上述气态烃,消耗O2的量最多的是________ 。
(3)等质量的上述气态烃,在充分燃烧时,消耗O2的量最多的是________ 。
(4)存在同分异构体的是_______ _。
(5)在120 ℃,1.01×105Pa条件下,某气态烃与足量的O2完全反应后,测得反应前后气体的体积没有发生改变,则该烃为________ 。
(6)10 mL某气态烃,在50 mL O2中充分燃烧,得到液态水,以及体积为35 mL的混合气体(所有气体体积均在同温同压下测定)。该气态烃是________ 。
某烃A 0.2mol在氧气中恰好完全燃烧,生成化合物B、C各1.0mol,试回答:
(1)烃A的分子式是____ ____。
(2)若取一定量的烃A充分燃烧后,生成B、C各2mol,则完全燃烧时消耗标准状况下的氧气的体积为____ _L。
(3)若烃A能使溴水褪色,则A可能的结构有 种,写出其中一种的结构简式___ _ _。
(4)若烃A能使溴水褪色,写出其最简单的同系物发生加聚反应的化学方程式________ ___。
(5)烃A与氢气发生加成反应的产物中,一氯代物有四种的结构简式为____ 。
某有机物0.1mol,与标准状况下5.6L氧气充分反应后,产物为CO、CO2、H2O的混合气体。将此混合气体通过浓硫酸,浓硫酸增重5.4g,再通过灼热氧化铜粉末,氧化铜质量减少1.6g;最后通过足量碱石灰,碱石灰增重8.8g。求该有机物的分子式。(书写计算过程)
为了研究在温度对苯催化加氢的影响,以检验新型镍催化剂的性能。采用相同的微型反应装置,压强为0.78Mpa,氢气、苯的物质的量之比为6.5:1。定时取样分离出氢气后,分析成分得如下表结果:
| 温度/℃ |
85 |
95 |
100 |
110~240 |
280 |
300 |
340 |
|
| 质量分数(%) |
苯 |
96.05 |
91.55 |
80.85 |
0 |
23.35 |
36.90 |
72.37 |
| 环己烷 |
3.95 |
8.45 |
19.15 |
100 |
76.65 |
63.10 |
27.63 |
下列说法错误的是( )
A.当温度超过280℃,苯的转化率迅速下降,可能是因为该反应为吸热的可逆反应
B.在110~240℃苯的转化率为100%。说明该镍催化剂活性较高,能够在较宽的温度范围内催化而且不发生副反应
C.增大压强与提高氢气、苯的物质的量比都有利于提高苯的转化率
D.由表中数据来看,随着反应温度的升高,苯的转化率先升高后降低
中国石油天然气勘探开发公司位于尼日尔的分支机构CNPC—尼日尔石油公司,日前在该国东部最新发现了2900万桶的石油储量,勘探小组在石油样品中发现一种烃的含氧衍生物。可用下图所示装置确定其分子式和其组成。(不考虑空气进入装置)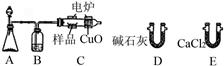
回答下列问题:
(1)A中发生反应的化学方程式为 。
(2)B装置的作用是 ,燃烧管C中CuO的作用是 。
(3)产生氧气按从左向右流向,燃烧管C与装置D、E连接。现甲、乙两位同学提出了两种连接方案。
方案1 甲同学认为连接顺序是:C→E→D
方案2 乙同学认为连接顺序是:C→D→E
请你评价两种连接方案,判断哪种方案正确并说明理由。
, 。
(4)准确称取1.8g烃的含氧衍生物X的样品,经充分燃烧后,D管质量增加2.64g,E管质量增加1.08g,实验测得X的蒸气密度是同温同压下氢气密度的45倍,则X的分子式为 ,1molX分别与足量Na、NaHCO3反应放出的气体在相同条件下的体积比为1∶1,X可能的结构简式为 。
有机物A仅含有C、H、O三种元素,可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
限选试剂:蒸馏水、2 mol·L-1盐酸溶液、2 mol·L-1 NaOH溶液、浓硫酸、NaHCO3粉末、金属Na、无水乙醇
| 实验步骤 |
实验结论 |
(1)A的质谱图如下: |
(1)证明A的相对分子质量为:__________。 |
| (2)将此9.0 g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4 g和13.2 g。 |
(2)证明A的分子式为: ________________。 |
| (3)另取两份9.0 g A分置于不同的试管中。 往其中一份A中加入足量的NaHCO3粉末充分反应,生成_______ L CO2(标准状况)。 往另一份A中加入足量的金属钠充分反应,生成________________________ L H2(标准状况)。 |
(3)证明A的分子中含有一个羧基和一个羟基。 |
(4)A的核磁共振氢谱如下图: |
(4)A的结构简式为: _________________________。 |
取3.40g只含羟基,不含其他官能团的液态饱和多元醇,置于5.00L氧气中,经点燃,醇完全燃烧,反应后气体体积减少0.56L,将气体经CaO吸收,体积又减少2.80L(所有气体体积均在标准状况下测定)。
(1)3.40g醇中C、H、O物质的量分别为:C________mol,H________mol,O________mol,该醇中C、H、O的原子个数比为__________。
(2)由以上比值能否确定该醇的分子式__________(填“能”或“否”)。其原因是____________。
(3)如果将多元醇的任意一个羟基换成一个卤原子,所得到的卤代物都只有1种,写出该饱和多元醇的结构简式_____________________.
(1)下列物质都能与Na反应放出H2: ①C2H5OH ②CH3COOH溶液 ③NaOH溶液,产生H2的速率由大到小的次序是 (填序号)
(2)某气态烃1体积只能与1体积氯气发生加成反应生成氯代烷,此氯代烷1mol可与4mol氯气生
完全的取代反应,则该烃的结构简式为
(3)常温常压下CH4和C2H6混合后平均组成为C1.5H5,则二者的体积比为 。若平均组成为C1.2H4.4
则二者的体积比为 。
完成以下实验:
用右图所示的装置制取溴乙烷;②进行溴乙烷的性质实验。在试管I中依次加入2 mL 蒸馏水、4 mL浓硫酸、2 mL 95%的乙醇和3g溴化钠粉末,在试管Ⅱ中注入蒸馏水,在烧杯中注入自来水。加热试管I至微沸状态数分钟后,冷却。试回答下列问题:
(1)试管I中浓硫酸与溴化钠加热反应生成氢溴酸,写出氢溴酸与乙醇在加热时反应的化学方程式 _。
(2)试管I中反应除了生成溴乙烷,还可能生成的有机物有 _ 、 (写出两种有机物的结构简式)。
(3)溴乙烷的沸点较低,易挥发,为了使溴乙烷冷凝在试管Ⅱ中,减少挥发,上图中采取的措施有 、 _。
(4)在进行溴乙烷与NaOH乙醇溶液共热的性质实验时,把生成的气体通过下图所示的装置。用下图装置进行实验的目的是 _;下图中右边试管中的现象是 ;水的作用是 。
试题篮
()