验证某有机物属于烃的含氧衍生物,应完成的内容是
| A.只要验证它完全燃烧后产物只有H2O和CO2 |
| B.只要测定其燃烧产物中H2O和CO2物质的量的比值 |
| C.测定完全燃烧时消耗有机物与生成H2O和CO2的物质的量之比 |
| D.测定该试样的质量及其试样完全燃烧后生成H2O和CO2的质量 |
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是(写出计算过程) 。
(2)X与金属钠反应放出氢气,反应的化学方程式是 。
(3)X与空气中的氧气在铜或银催化下反应生成Y,Y的结构简式是 。
(4)X与酸性高锰酸钾溶液反应可生成Z,在加热和浓硫酸作用下,X与Z反应可生成一种有香味的物质W。若184 g X和120 g Z反应能生成106 g W,计算该反应的产率(实际产量与理论产量之比) 。
(1)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有碳碳双键,核磁共振氢谱表明分子中只有一种类型的氢。
A的结构简式为__________,名称为___________________ 。
A中的碳原子是否都处于同一平面?________(填“是”或“不是”);A分子是否存在顺反异构体________(填“是”或“否”)。(每空1分)
(2)对下列物质进行系统命名:(每空1分)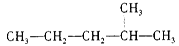 :__________;CH2=CHCH2CH3:__________;
:__________;CH2=CHCH2CH3:__________;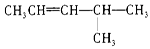 :__________;
:__________;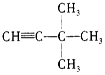 :__________
:__________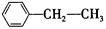 :__________。
:__________。
将一定质量的有机物充分燃烧后的产物通入足量石灰水中,完全吸收后经过滤,得到20 g沉淀,滤液质量比原石灰水减少5.8 g。该有机物可能是
| A.乙烯 | B.乙二醇 | C.乙醇 | D.乙醚 |
甲醛(CH2O)、乙酸(C2H4O2)、和丙酸(C3H6O2)组成的混合物中,氧元素的质量分数为44%,则碳元素的质量分数为
| A.44 % | B.48 % | C.56 % | D.无法计算 |
(5分)某烃分子量为72,现取3.6g该烃完全燃烧,将全部产物依次通入足量的浓硫酸和碱石灰,浓硫酸增重5.4g,碱石灰增重11g,求:
(1)该烃的分子式 (3分)
(2)已知该烃的一氯代物只有一种,写出该烃的结构简式______________________;
两种气态烃组成的混合气体0.1 mol,完全燃烧得0.15 mol CO2和3.6 g H2O,下列关于该混合气体的说法正确的是
| A.一定有乙烯 | B.一定没有乙烯 | C.一定有乙烷 | D.一定有甲烷 |
有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?(4分)
(2)通过计算确定该有机物的分子式。(4分)
5.8g有机物完全燃烧,只生成CO2和H2O蒸气,其体积比为1:1(同压同温),若把它们通过碱石灰,碱石灰增加18.6g,同量的有机物与0.1mol乙酸完全发生酯化反应.又知该有机物对空气的相对密度为2。(简要写出求算过程)
求:(1)有机物的相对分子质量;
(2)有机物的分子式;
(3)有机物的结构简式 。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 |
解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为: 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为: 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团: ___________。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团:____________。 |
(4)A的核磁共振氢谱如下图: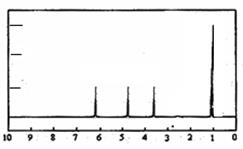 |
(4)A中含有______种氢原子。 |
| (5)综上所述,A的结构简式 。 |
下列各组混合物总物质的量均为a mol,当每组物质以任意物质的量之比混合完全燃烧时,消耗O2的量不变的是
| A.甲烷、甲醇 | B.乙烯、环丙烷 |
| C.乙炔、苯 | D.乙醇、丙烯酸 |
2002年诺贝尔化学奖获得者的贡献之一是发明了对有机分子的结构进行分析的质谱法。其方法是让极少量(10-9 g左右)的化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+、……然后测定其质荷比β。设H+的质荷比为1,某有机物样品的质荷比如下图(假设离子均带一个单位正电荷,信号强度与该离子多少有关),则该有机物可能
| A.CH3OH | B.C3H8 | C.C2H4 | D.CH4 |
某有机物的相对分子质量为60,1 mol该有机物完全燃烧,生成36 g H2O和44.8 L CO2(标准状况下)。
(1)求分子式
(2)又知此有机物具有弱酸性,能与金属钠反应,也能与碱溶液反应,试写出它可能的结构简式。
以CnHmCOOH所表示的羧酸0.1mol加成时需32g溴,0.1mol该羧酸完全燃烧,产生CO2和H2O共3.4mol,该羧酸是
| A.C15H27COOH | B.C15H31COOH | C.C17H31COOH | D.C17H33COOH |
试题篮
()