乙烯与乙烷混合气体共a mol,与b mol的氧气共存于一密闭容器中,点燃后充分反应,乙烯和乙烷全部消耗完,得到CO到CO2的混合气体和45g水。试求:
(1)当a=1时,乙烯和乙烷的物质的量之比n(C2H4):n(C2H6)= 。
(2)当a=1,且反应后CO和CO2混合气体的物质的量为反应前氧气的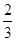 时,则b= ,得到的CO和CO2的物质的量之比n(CO):n(CO2)= 。
时,则b= ,得到的CO和CO2的物质的量之比n(CO):n(CO2)= 。
(3)a的取值范围是 。
3-丁酮酸乙酯在有机合成中用途极广,广泛用于药物合成,还用作食品的着香剂。其相对分子质量为130,常温下为无色液体,沸点181℃,受热温度超过95℃摄氏度时就会分解;易溶于水,与乙醇、乙酸乙酯等有机试剂以任意比混溶;实验室可用以乙酸乙酯和金属钠为原料制备。乙酸乙酯相对分子质量为88,常温下为无色易挥发液体,微溶于水,沸点77℃。
【反应原理】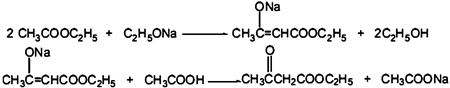
【实验装置】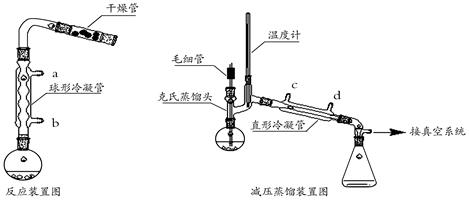
【实验步骤】
1.加热反应:向反应装置中加入32 mL(28.5g,0.32mol)乙酸乙酯、少量无水乙醇、1.6 g(0.07mol)切细的金属钠,微热回流1.5~3小时,直至金属钠消失。
2.产物后处理:冷却至室温,卸下冷凝管,将烧瓶浸在冷水浴中,在摇动下缓慢的加入32 mL 30%醋酸水溶液,使反应液分层。用分液漏斗分离出酯层。酯层用5%碳酸钠溶液洗涤,有机层放入干燥的锥形瓶中,加入无水碳酸钾至液体澄清。
3.蒸出未反应的乙酸乙酯:将反应液在常压下蒸馏至100℃。然后改用减压蒸馏,得到产品2.0g。
回答下列问题:
(1)从反应原理看,无水乙醇的作用是 。
(2)反应装置中加干燥管是为了 。两个装置中冷凝管的作用 (填“相同”或“不相同”),冷却水进水口分别为 和 (填图中的字母)。
(3)产物后处理中,滴加稀醋酸的目的是 ,稀醋酸不能加多了,原因是 。用分液漏斗分离出酯层的操作叫 。碳酸钠溶液洗涤的目的是 。加碳酸钾的目的是 。
(4)采用减压蒸馏的原因是 。
(5)本实验所得到的3-丁酮酸乙酯产率是 (填正确答案标号)。
| A.10% | B.22% | C.19% | D.40% |
.药物Z可用于治疗哮喘、系统性红斑狼疮等,可由X(1,4-环己二酮单乙二醇缩酮)和Y(咖啡酸)为原料合成,如下图:
(1)化合物X的有 种化学环境不同的氢原子。
(2)下列说法正确的是 。
| A.X是芳香化合物 | B.Ni催化下Y能与5molH2加成 |
| C.Z能发生加成、取代及消去反应 | D.1mol Z最多可与5mol NaOH反应 |
(3)Y与过量的溴水反应的化学方程式为 。
(4)X可以由 (写名称)和M(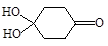 )分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
)分子间脱水而得;一定条件下,M发生1个—OH的消去反应得到稳定化合物N(分子式为C6H8O2),则N的结构简式为 (已知烯醇式不稳定,会发生分子重排,例如:
 )。
)。
(5)Y也可以与环氧丙烷(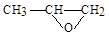 )发生类似反应①的反应,其生成物的结构简式为 (写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有 种。
)发生类似反应①的反应,其生成物的结构简式为 (写一种);Y的同分异构体很多种,其中有苯环、苯环上有三个取代基(且酚羟基的位置和数目都不变)、属于酯的同分异构体有 种。
三苯甲醇(C6H5)3C-OH是一种重要的化工原料和医药中间体。实验室合成三苯甲醇的实验装置如图所示。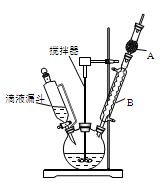
已知:①过程中生成的中间物质格氏试剂易发生水解反应;
②部分相关物质的沸点如下:
| 物质 |
沸点/℃ |
| 三苯甲醇 |
380 |
| 乙醚 |
34.6 |
| 溴苯 |
156.2 |
③三苯甲醇的相对分子质量为260。
请回答下列问题:
(1)装置中玻璃仪器B的名称为 ;装有无水CaCl2的仪器A的作用是 。
(2)装置中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持温度约为40℃,可以采用 加热方式。
(3)制得的三苯甲醇粗产品中含有乙醚、溴苯、氯化铵等杂质,可以设计如下提纯方案:
其中,操作①的名称是 ;洗涤液最好选用 (填字母序号)。
a.水 b.乙醚 c.乙醇 d.苯
检验产品已经洗涤干净的操作为 。
(4)纯度测定:称取2.60 g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不反应),充分反应后,测得生成的气体在标准状况下的体积为100.80 mL。则产品中三苯甲醇的质量分数为 。
溴乙烷是一种难溶于水、密度约为水的密度的1.5倍、沸点为38.4℃的无色液体。实验室制取溴乙烷的反应如下:
NaBr+H2SO4(浓) NaHSO4+HBr CH3CH2OH+HBr →CH3CH2Br+H2O
NaHSO4+HBr CH3CH2OH+HBr →CH3CH2Br+H2O
已知反应物的用量:①NaBr(s) 0.3 mol,②浓硫酸36 mL(98%、密度1.84 g•cm–3),
③乙醇0.25 mol,④水25 mL,其中乙醇的密度为水的密度的4/5。
试回答:
(1)仅用如下图所示仪器安装制取和收集溴乙烷的装置,要求达到安全、损失少、不污染环境的目的,有关仪器(相关胶塞上已打合适的孔,胶管未画出。)的选择和连接顺序为 (填数字)。
(2)在实验过程中,考虑到浓硫酸性质的特殊性,试剂加入的合理顺序为________________(请填写试剂的编号);
(3)若试剂加入过快,可看到烧瓶内有红棕色气体产生,写出反应的化学方程式:
。
(4)判定有溴乙烷生成的现象是__________________________。从棕黄色的粗溴乙烷制取无色的溴乙烷,第一步可以加入蒸馏水或NaHSO3溶液,本操作中通常使用的仪器是__________。
(5)本实验的产率为60%,则可制取溴乙烷 g。
溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下,按下列合成步骤回答问题: (1)在加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体。继续滴加至液溴滴完。装置d的作用是 ,
(1)在加入15 mL无水苯和少量铁屑。在b中小心加入4.0 mL液态溴。向a中滴入几滴溴,有白雾产生,是因为生成了___________气体。继续滴加至液溴滴完。装置d的作用是 ,
写出a中有关反应化学方程式 。
(2)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10 mL水,然后过滤除去未反应的铁屑;
②滤液依次用l0 mL水、8 mL l0%的NaOH溶液、10 mL水洗涤。其中NaOH溶液洗涤的作用是除去HBr和未反应的Br2;
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤。加入氯化钙的目的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为__________________,要进一步提纯,下列操作中必须的是____________(填入正确选项前的字母);
A、重结晶 B、过滤 C、蒸馏 D、萃取
(4)在该实验中,a的容积最适合的是______(填入正确选项前的字母)。
A、25 mL B、50 mL C、250 mL D、509 mL
(5)在最新的家用汽车的调查中发现,新车中气体的质量不符合标准。汽车污染主要来源于汽车配件及材料.它们都会产生大量有毒的有机物气体.其中一种有毒气体的质谱图如图:
①则由图可知该分子的相对分子质量是________。
②若该分子的核磁共振氢谱中有4个吸收峰则有机物的名称为_______。
③其苯环上的一氯代物有________种。
(8分)由H2、C2H4、C2H2组成的1L混合气体在一定条件下发生加成反应后,气体总体积变成XL。请回答(气体体积均在标准状况下测定):
(1)当反应后三种气体均无剩余时,X的取值范围是 ________________:若X=0.4时,原混合气体中H2、C2H4、C2H2的体积比为________________。
(2)当X=0.6时,且反应后混合气体密度为0.714g/L时,原混合气体H2、C2H4、C2H2的体积比为 ________________________。
(12分)碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,含氧元素的质量分数为31.58%.A遇FeCl3溶液显紫色,其苯环上的一氯取代物有两种,请回答下列问题:
(1)A的分子式是______________。
(2)若A能与NaHCO3溶液反应,A的结构简式为_________________;写出A与NaHCO3溶液反应的化学方程式_______________________。
(3)如A可以发生如图 所示转化关系,D的分子式为
所示转化关系,D的分子式为
C10H12O3,A与C反应的化学方程式__________________________
(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290℃,熔点18.17℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度.甲、乙两装置相比较,乙装置有哪些优点__________。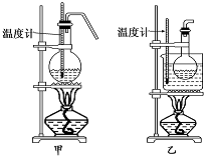
工业上目前使用两种方法制取乙醛:(1)乙炔水化法;(2)乙烯氧化法。下列两表提供生产过程中原料、反应条件、原料平衡转化率、产量等有关的信息情况:
表一:原料、反应条件、平衡转化率、日产量
| |
乙炔水化法 |
乙烯氧化法 |
| 原料 |
乙炔、水 |
乙烯、空气 |
| 反应条件 |
HgSO4、100~125℃ |
PdCl2-CuCl2、100~125℃ |
| 平衡转化率 |
乙炔平衡转化率90%左右 |
乙烯平衡转化率80%左右 |
| 日产量 |
2.5吨(某设备条件下) |
3.6吨(相同设备条件下) |
表二:原料来源生产工艺
| |
原料生产工艺过程 |
| 乙炔 |
 |
| 乙烯 |
来源于石油裂解气 |
根据上述两表,回答下列问题:
(1)写出下列化学方程式:
a.乙炔水化法制乙醛__________________________________________________。
b.乙烯氧化法制乙醛______________________________________________。
(2)从两表中分析,现代工业上乙烯氧化法逐步取代乙炔水化法(从环境、原料来源、产率和产量、能耗等角度),分析可能的原因:________________________________。
(3)从化学反应速率角度分析,在相同条件下,两种制取乙醛的方法哪种快?
___________________________________________________________________。
(4)若将上述两种方法的反应条件,均增加“100atm”,原料平衡转化率_______(填增大、减小、不变);而实际生产中不采用的理由是_____________________________。
(5)若乙烯由石油裂化(裂化气混合气体的平均化学式CnHm、m>2n),进一步完全催化裂解而来,得到体积百分含量分别为:甲烷:5%、乙烯:40%、丙烯:10%、其余为丁二烯和氢气(气体体积均在同温同压下测定)。若得到40mol乙烯,求:能够得到丁二烯和氢气的物质的量各为多少?
等质量的甲、乙、丙、丁、戊、己6种只含C、H、O三种元素的有机物,分别充分燃烧时,消耗等量的O2,且生成的气体全部分别通过足量的无水硫酸铜后再分别通过足量的碱石灰,无水硫酸铜与碱石灰质量增重之比均为9∶22。已知:
① 6 M(甲)=3 M(乙)=3 M(丙)=3 M(丁)=2 M(戊)=M(己)=180;
② 乙、戊的水溶液可使甲基橙试液变红,相互之间在一定条件下能发生酯化反应;
③ 戊的核磁共振氢谱有4种峰,峰面积之比为3∶1∶1∶1;
④ 甲、丙、丁、己能发生银镜反应。丙不易溶于水但丁易溶于水。
请回答下列问题:
(1)甲的结构式为 ;己的一种可能的结构简式为 。
(2)乙、丙、丁三者之间的关系是 ;丁的结构简式为 。
(3)写出2分子戊生成1分子环状酯的化学方程式 。
(9分)有机物A是烃,有机物B易溶于水,且1 mol B能跟足量的钠反应生成标准状况下的H2 11.2 L,但不能与NaHCO3溶液反应,已知A通过如下转化关系可制得化学式为C4H8O2的酯E,且当D→E时,式量增加28。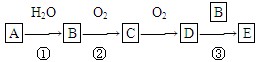
请回答下列问题:
(1)A在标准状况下的密度为________,反应①的原子利用率为________。
(2)B的密度比水________, B中含氧官能团的名称为________。
(3)反应②的化学方程式为______________。
(4)反应③的反应类型为 。
(5)4.4 g C物质完全燃烧消耗 mol氧气。
(6)若D→E时,式量增加m,则B的式量为 。(用含m的代数式表示)
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空:(1)A的相对分子质量为 。 |
| (2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(2)A的分子式为_____ ___。 |
| (3)另取A 9.0 g,跟足量NaHCO3粉末反应,生成 2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)用结构简式表示A中含有的官能团_____ _、___ ____。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有__ ______种氢原子。 |
| (5)综上所述,A的结构简式为______ ____。 |
某饱和有机物A由碳、氢、氧三种元素组成,现取3g A与4.48L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重3.6g,碱石灰增重4.4g。回答下列问题:
(1)3gA中所含氢元素和碳元素的物质的量各是多少?
(2)通过计算确定该有机物的分子式。
(3)若核磁共振氢谱中出现三个信号峰,且强度之比为3:3:2,请写出该有机物的结构简式。
有机物A〜M有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应,F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。

请回答:
(1)B、F的结构简式分别为 、 。
(2)反应①〜⑦中,属于消去反应的是 (填反应序号)。
(3)D发生银镜反应的化学方程式为 ;反应⑦的化学方程式为 。
(4) A的相对分子质量在180~260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为 。
(5)符合下列条件F的同分异构体共有 种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
间硝基苯胺(Mr=128)是一种重要的染料中间体。它是一种黄色针状结晶,微溶于水,随温度升高溶解度增大,溶于乙醇、乙醚、甲醇。间硝基苯胺可选用间二硝基苯与碱金属多硫化物进行选择性还原,其反应式如下: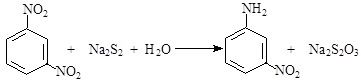
已知:R-NH2 + H+ → R-NH3+
实验步骤:
①在100mL锥形瓶中加入8g结晶硫化钠与30mL水,搅拌溶解。再加入2g硫黄粉,缓缓加热并不断搅拌到硫黄粉全部溶解,冷却后备用。
②在150mL三颈烧瓶中加入4.74g间二硝基苯(Mr=158)与40mL水,安装机械搅拌装置、滴液漏斗和回流冷凝管如图所示,将步骤①配制的多硫化钠溶液加入滴液漏斗。
③加热三颈烧瓶至瓶内微微沸腾,开动搅拌使间二硝基苯与水形成悬浮液。慢慢滴加多硫化钠溶液,滴加完毕后继续搅拌回流30min。移去热源,用冷水浴使反应物迅速冷却到室温后,减压过滤,滤饼洗涤三次。
④在150mL某容器中配制稀盐酸(30mL水加7mL浓盐酸),将上述粗产物转移进该容器,加热并用玻璃棒搅拌,使间硝基苯胺溶解,冷却到室温后减压过滤。
⑤冷却滤液,在搅拌下滴加过量浓氨水到pH=8,滤液中逐渐析出黄色的间硝基苯胺。
⑥冷却到室温后减压过滤,洗涤滤饼到中性,抽干,产物重结晶提纯,在红外灯下干燥,称重,得2.56g。
回答下列问题:
(1)滴液漏斗较普通分液漏斗的优点 ;第④步中配制稀盐酸的容器名称为 。
(2)间二硝基苯和间硝基苯胺都有毒,因此该实验应在 内进行。
(3)在铁和盐酸作用制得初生态氢原子(还原性远强于碱金属多硫化物)也可以将硝基还原为氨基,却未被采用,其可能原因为 。
(4)第④步用盐酸溶解粗产品,而不用水的原因 。
(5)第③步中滤饼洗涤三次,可选用的洗涤剂为( );第⑥步产物要进行重结晶,可选用的试剂为( )。
| A.冷水 | B.热水 | C.乙醚 | D.乙醇 |
(6)第③步中,搅拌使间二硝基苯与水形成悬浮液后再滴加多硫化钠溶液,其原因为 。
(7)第⑥步中要将滤饼洗涤到中性,检验方法为 。
(8)该反应的产率为 。
试题篮
()