关于非金属元素O、N、S、Cl的叙述,正确的是
| A.在通常情况下,其单质均为气体 | B.非金属性按O、N、S、Cl顺序依次递减 |
| C.每种元素只能形成一种氢化物 | D.都属于主族元素 |
向存在大量Na+、Cl-的溶液中通入足量的NH3后,该溶液中还可能大量存在的离子组是
A.K+、Br-、 |
B.Al3+、H+、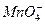 |
C. 、Fe3+、 、Fe3+、 |
D.Ag+、Cu2+、 |
下列物质之间的转化都一步能实现的是
| A.Si→SiO2→H2SiO3→Na2SiO3 |
| B.Al→Al2O3→Al(OH)3→NaAlO2 |
| C.N2→NH3→NO→NO2→HNO3→NO2 |
| D.S→SO3→H2SO4→SO2→Na2SO3→Na2SO4 |
下列事实中,能说明氯原子得电子能力比硫原子强的是
①盐酸的酸性比氢硫酸(H2S水溶液)酸性强 ②HCl的稳定性比H2S大 ③Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ④Cl2能与H2S反应生成S ⑤还原性:Cl-<S2-
| A.①②③④ | B.②③④ | C.①②③④⑤ | D.②③④⑤ |
根据硝酸尾气处理原理:NO2+NO+2NaOH====2NaNO2+H2O,下列气体不可能完全被过量的NaOH溶液吸收的是(n表示物质的量)
| A.n(NO2)∶n(O2)="4∶1" |
| B.n(NO2)∶n(NO)=1∶1 |
| C.n(NO)∶n(O2)="4∶1" |
| D.n(NO2)∶n(NO)=1∶4 |
下列有关化工生产和物质的性质应用,说法正确的是
| A.生产玻璃和水泥都要用到的原料是石灰石和黏土 |
| B.工业上金属Na、Mg、Al都是用电解熔融的氯化物制得的 |
| C.食盐、Br2、Mg(OH)2都可以从海水中提取 |
| D.氯气、漂白粉、明矾都可以用于自来水的消毒 |
常温常压下,V1L的NO2和O2的混合气体,被水充分吸收后,剩余V2 L氧气,则原混合气体中NO2的体积为
A. (V1-V2) L (V1-V2) L |
B. (V1+4V2) L (V1+4V2) L |
C. (V1-3V2) L (V1-3V2) L |
D. (4V1+3V2) L (4V1+3V2) L |
下列各组物质仅用水及物质间相互反应就能区别的一组是( )
| A.Na2O2 Al2(SO4)3 MgCl2 K2CO3 |
B.BaCl2 Na2SO4 CaCO3 KOH |
| C.AgNO3 NaCl KCl CuCl2 | |
| D.Fe2(SO4)3 K2CO3 K2SO4 BaCl2 |
如右图所示,试管中盛装的是红棕色气体(可能是混合物),当倒扣在盛有水的水槽中时,试管内水面上升,但不能充满试管,当向试管内鼓入一定量氧气后,可以观察到试管中水柱继续上升,经过多次重复后,试管内完全被水充满,对原来试管中盛装的气体判断不正确的是( )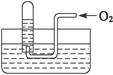
| A.可能是空气与NO2的混合气体 |
| B.可能是O2与NO2的混合气体 |
| C.可能是NO与NO2的混合气体 |
| D.可能是NO2一种气体 |
如图,锥形瓶内盛有气体X,滴管内盛有液体Y,若挤压滴管,使Y滴入瓶中,振荡,过一会可见小气球a鼓起,气体X和液体Y不可能是
| A.X是NH3,Y是水 |
| B.X是SO2,Y是NaOH浓溶液 |
| C.X是CO2,Y是稀硫酸 |
| D.X是HCl,Y是NaOH稀溶液 |
设 NA表示阿伏加德罗常数,下列说法不正确的是
| A.常温常压下,11.2 L氧气所含的原子数为NA |
B.1.8 g 的 中含有的电子数为NA 中含有的电子数为NA |
| C.常温常压下,48 g O3含有的氧原子数为3NA |
| D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA |
向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如下图所示。则下列分析与判断不正确的是(不计CO2的溶解) ( )
| A.若OB=0,则形成溶液M所发生的离子反应方程式为:OH-+CO2=HCO3- |
| B.若OB=BC,则溶液M为Na2CO3溶液 |
| C.若OB>BC,则溶液M中大量存在的阴离子为CO32-和HCO3- |
| D.若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3) |
试题篮
()