(10分)胆矶(CuSO4•5H20)广泛用于电镀工艺,在医药上用做收敛剂、防腐剂和催吐剂。以下是用铜粉氧化法生产胆矾的流程图: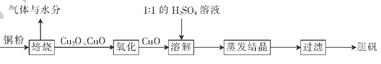
(1 )写出溶解过程中发生反应的离子方程式:____________
(2)1:1的H2SO4溶液是由l体积98%的H2SO4与1体积水混合而成。配制该硫酸所需的硅酸盐质仪器除玻璃棒外.还需要______、______。
(3)已知氧化亚铜(Cu2O)与稀H2SO4反应有CuSO4和Cu生成。假设焙烧后固体只含铜的氧化物.为检验该固体的成分.下列实验设计合理的是__________________(填字母)。
| A.加人稀H2SO4,若溶液呈蓝色,说明固体中一定有CuO |
| B.加人稀H2SO4,若有红色沉淀物生成,说明固体中一定有Cu2O |
| C.加人稀HNO3,若有无色气体(随即变成红棕色:)产生,说明固体中有Cu2O |
| D.加人稀HNO3,若固体全部溶解,说明固体中没有Cu2O |
(4)取2.50g胆矶样品,逐渐升温加热分解,分解过程的热重曲线(样品质量随温度变化的曲线)如图所示。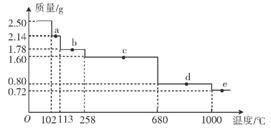
①a点时固体物质的化学式为______,c点时固体物质的化学式为______。
②10000C时发生反应的化学方程式为_________________________
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂。以下是过氧化氢法生产亚氯酸钠的工艺流程图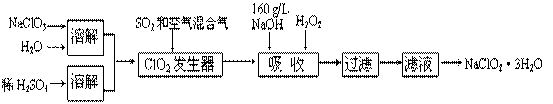
已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O。
②ClO2的沸点为283 K,纯ClO2易分解爆炸,常用稀有气体或空气稀释防止爆炸性分解
③HClO2在25 ℃时的电离常数与硫酸的第二步电离常数相当,可视为强酸。
(1)160 g/L NaOH溶液的物质的量浓度为____________________ 。若要计算该溶液的质量分数,还需要的一个数据是__________________ 。
(2)ClO2发生器中所发生反应的离子方程式为__________________________
(3)吸收塔中为防止产生NaClO2被继续还原成NaCl,所用还原剂的还原性应适中。除H2O2处,还可以选择的还原剂是( )(填序号)
| A.Na2O2 | B.Na2S | C.FeCl2 | D.KMnO4 |
(4)写出吸收塔中发生反应的化学方程式____________________________
(5)从滤液中得到NaClO2·3H2O晶体还必须进行的操作是_____________ (填操作步骤)
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料,由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意如下: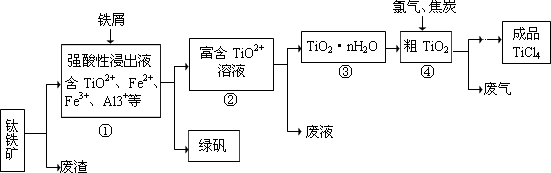
回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生。
2Fe3++Fe === 3Fe2+
2TiO2+(无色) +Fe+4H+=== 2Ti3+(紫色) +Fe2++2H2O
Ti3+(紫色) +Fe3++H2O ="==" TiO2+(无色) +Fe2++2H+
加入铁屑的作用是____________________________________________________________。
(2)在②→③工艺中需要控制条件以形成TiO2·n H2O溶胶,该分散质颗粒直径大小在____________________范围。
(3)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是_____________________________________(只要求写出一项)。
(4)依据下表信息,要精制含少量SiCl4杂质的TiCl4 ,可采用_____________方法。
| |
TiCl4 |
SiCl4 |
| 熔点/℃ |
-25.0 |
-68.8 |
| 沸点/℃ |
136.4 |
57.6 |
(12分)高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
| 湿法 |
强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液 |
| 干法 |
Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物 |
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示 :
:
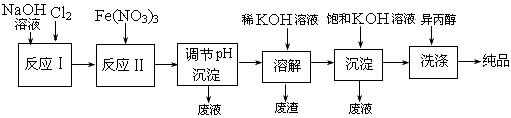
|
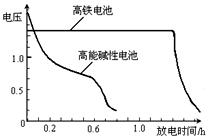
 ,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
,上图为该电池和常用的高能碱性电池的放电曲线,由此可得出的高铁电池的优点有 ▲ 、 ▲ 。
以硫酸工业的尾气、氨水、石灰石、焦炭及碳酸 氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下:
氢铵和KCl为原料可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸氢铵等物质。合成路线如下: 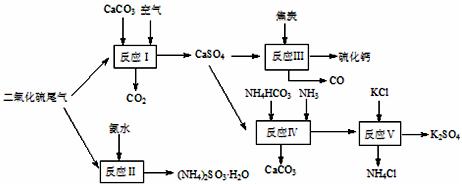
(1)已知对苯二酚是一种强还原剂。生产中,反应Ⅱ中往往需要向溶液 中加入适量的对苯二酚等物质,其目的是 ▲ 。
中加入适量的对苯二酚等物质,其目的是 ▲ 。
(2)下列有关说法正确的是 ▲ 。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应Ⅲ中发生反应的化学方程式为:CaSO4+4C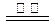 CaS +4CO↑ CaS +4CO↑ |
| C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应Ⅴ中的副产物氯化铵可用作氮肥 |
(3)反应Ⅴ反应液用40%乙二醇溶液,温度控制在25℃,硫酸钾的产率超过90%,其原因是 ▲ 。
(4)(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为N2,试写出二氧化氮与亚硫酸铵反应的化学方程式 ▲ 。
材料与化学密切相关,表中对应关系错误的是
| 选项 |
材 料 |
主要化学成分 |
| A |
刚玉、金刚石 |
三氧化二铝 |
| B |
大理石、石灰石 |
碳酸钙 |
| C |
普通水泥、普通玻璃 |
硅酸盐 |
| D |
沙子、石英、光导纤维 |
二氧化硅 |
下列有关新闻事件的叙述正确的是
| A.在结冰的路面上撒盐,是利用盐与水发生化学反应放出大量热量,促使冰雪融化 |
| B.我国决定推广使用车用乙醇汽油,乙醇汽油是一种新型的化合物,属于可再生能源 |
| C.制造航空服的“连续纤维增韧”材料主要成分由碳化硅、陶瓷和碳纤维复合而成,它是一种新型无机非金属材料 |
| D.“绿色荧光蛋白质”是由氨基酸加聚而成的高分子化合物 |
化学与生产、生活、社会密切相关。下列有关说法中不正确的是
A.日本福岛第一核电站核泄漏的具有放射性的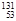 I、 I、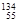 Cs可能持续影响数十年。其中 Cs可能持续影响数十年。其中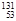 I的中子数比 I的中子数比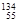 Cs的中子数少1 Cs的中子数少1 |
| B.我国部分城市已陆续开始推广使用“甲醇汽油”。“甲醇汽油”具有降低排放、节省石油、安全方便等特点。 |
| C.“反式脂肪酸”对人类健康危害极大,它的形成是由于油脂氢化过程中双键的顺式结构转变成室温下更稳定的固态反式结构 |
| D.废弃的塑料、金属、纸制品是可回收利用的资源,而玻璃是不可回收再利用 |
A是生产某新型工程塑料的基础原料之一,其组成元素为C、H、O,其分子结构模型如图所示(图中球与球之间连线代表化学键,不一定表示单键)。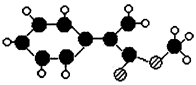
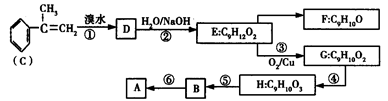
(1)根据分子结构模型写出A的结构简式______________________________。
(2)写出反应类型:反应①、⑤分别属于_______________、_______________。
(3)B与F均能与溴水中的溴发生加成反应,F的结构简式为______________________。
写出反应⑥的化学方程式(注明必要的反应条件)______________________________。
(4)已知G有多种芳香族同分异构体,其中符合下列条件的同分异构体共有___________种。
①能与稀硫酸及NaOH溶液反应
②能发生银镜反应
③分子中有一个甲基
信息、材料、能源被称为新科技革命的“三大支柱”。下列观点或做法错误的是
| A.在即将到来的新能源时代,核能、太阳能、氢能将成为主要能源 |
| B.加大煤炭的开采速度,增加煤炭燃料的供应量,以缓解石油危机 |
| C.光缆在信息产业中有广泛应用,制造光缆的主要材料是二氧化硅 |
| D.高温结构陶瓷氮化硅(Si3N4)具有较高的硬度和耐磨性,可用于制造汽车发动机 |
“神舟”飞船上的太阳能帆板采用了大量先进的复合材料,以便在尽可能提高发电效能的同时,减轻其自身质量,其身价达到了上千万元。下列说法不符合事实的是
| A.复合材料的使用可以使太阳能帆板承受超高温 |
| B.复合材料的使用可以使“神舟”飞船质量变轻 |
| C.复合材料的使用可以使太阳能帆板承受超高强度的改变 |
| D.复合材料的使用可以使太阳能帆板承受温差造成的热胀冷缩的难题 |
材料科学是近年来与化学有关的科学研究热点。某新型无机非金属材料K由两种非金属元素组成。它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。它是以中学化学中常见物质为原料来生产的。下图虚线框内的其它转化是为探究C的组成而设。G、F、H均为难溶于水的白色固体;图中C、H、K均为含A元素。其余物质均为中学化学中常见物质。
 |
请回答下列问题:
(1)指出K可能所属的晶体类型 ,K中含有的化学键类型为 。
(2)写出化学式:化合物C ;化合物F 。
(3)写出反应③的化学方程式: 。
(4)写出反应⑤的离子方程式: 。
(5)化合物K与化合物C类似,也能在一定条件下与水反应生成两种化合物,请写出K与水反应的化学方程式: 。
试题篮
()