下列与化学有关的说法中正确的是
| A.高温结构陶瓷和光导纤维均属新型无机非金属材料 |
| B.风力发电和火力发电均能将化学能转化为电能 |
| C.二氧化碳和氮气均是造成温室效应的气体 |
| D.煤的干馏与石油的分馏均属于化学变化 |
聚合铝(PAC)是一种新型高效的无机高分子絮凝剂,广泛用于水的处理。用铝灰、铝土矿、铝渣等为原料(主要成分为Al、Al2O3)可制取聚合铝。实验步骤如下:
聚合铝(PAC)的分子式为[Al2(OH)aCl b]m,聚合铝中OH-与Al3+的比值对净水效果有很大影响,定义盐基度B=n(OH-)/3n(Al3+),当B=2/3时,b = (填入合适数字)。
工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: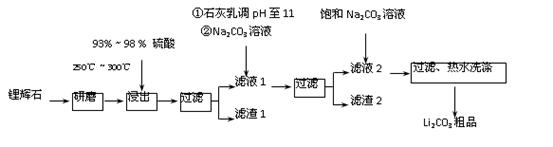
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中反应的离子方程式是 。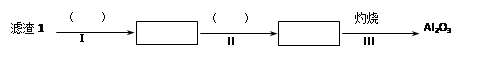
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡移动原理解释) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
材料与化学密切相关,表中对应关系不正确的是
| |
材料 |
主要化学成分 |
| A. |
陶瓷餐具 |
硅酸盐 |
| B. |
计算机芯片 |
晶体硅 |
| C. |
合金钢 |
铁碳铬硅等合金 |
| D. |
金刚砂 |
二氧化硅 |
下列有关金属的工业制法中,正确的是
| A.制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 |
| B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁 |
| C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 |
| D.炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
钛白粉(主要成分是Ti02),覆盖能力强,折射率高,无毒,广泛用于油漆、塑料、造纸等行业,还可用作乙醇脱水、脱氢的催化剂。下图是以钛铁矿(主要成分FeTi03,钛酸亚铁)为主要原料生产钛白粉的工艺流程图,回答下列问题: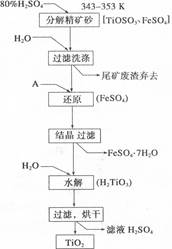
(1)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是 ;上述制备Ti02的过程中,所得到的副产物是 ,可回收利用的物质是:___________________。
(2)写出TiOS04溶液在加热条件下水解反应的离子方程式:
(3)为测定TiOS04的含量,首先取待测钛液10 mL用水稀释至100 mL,加过量铝粉,充分振荡,使其完全反应:3Ti02+ +Al+6H+==3Ti3++AL3++3H20。过滤后,取出滤液20 mL,向其中滴加2~3滴KSCN溶液作指示剂,用酸式滴定管滴加0.1mol·L-1 FeCl3溶液,当溶液出现红色达到滴定终点,用去了30mL FeC13溶液。待测钛液中TiOS04的物质的量浓度是____________________。
草酸亚铁可用于合成锂电池的正极材料硅酸亚铁锂(Li2FeSiO4)等,其制备过程主要包括:
a.将硫酸亚铁铵(NH4)2Fe(SO4)2·6H2O晶体溶于适量蒸馏水,加入适量稀硫酸酸化。
b.将上述溶液煮沸,逐滴加入H2C2O4溶液,直至沉淀完全。
c.静置、倾去上层清液、过滤、洗涤、50℃以下烘干。试回答下列问题:
(1)配制(NH4)2Fe(SO4)2·6H2O溶液时,需加入少量稀硫酸,目的是 。
(2)将制得的产品(FeC2O4·2H2O)在氩气气氛中进行热重分析,结果如图(TG%表示残留固体质量占原样品总质量的百分数)。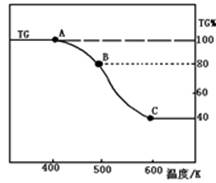
①则A-B发生反应的化学方程式为: 。
②精确研究表明,B-C实际是分两步进行的,每步释放一种气体,其中第一步释放的气体相对分子质量较第二步的小,试写出B-C两步反应的方程式: 、
;
(3)Li2CO3、FeC2O4·2H2O和SiO2粉末均匀混合,在800℃. 的氩气中烧结6小时,即可制成硅酸亚铁锂。①合成硅酸亚铁锂的化学方程式为: 。
②该锂电池放电时的总反应式为LiFeSiO4+Li=Li2FeSiO4,写出相应的电极反应式:
正极 、负极 。
MnSO4·H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2还原MnO2矿制备MnSO4·H2O过程如下:
已知:常温时部分硫化物难溶盐的Ksp:CuS--6.3×10-36、PbS--1.0×10-28、NiS--2.0×10-26、MnS--2.5×10-10,请回答下列问题:
(1)生产中MnO2矿粉碎的目的是 。(2)除铁发生的离子反应方程式为 。
(3)除重金属离子后,若混合溶液中Cu2+、Pb2+、Ni2+的浓度均为1.0×10-5mol/L,则c(S2-)最大= mol/L。
(二):性质—热稳定性:MnSO4·H2O在1150℃高温下分解的产物是Mn3O4、含硫化合物、水,在该条件下硫酸锰晶体分解反应的化学方程式是
(三)废水处理:工厂废水中主要污染为Mn2+和Cr6+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,(1)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 时锰、铬去除率最好
(2)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好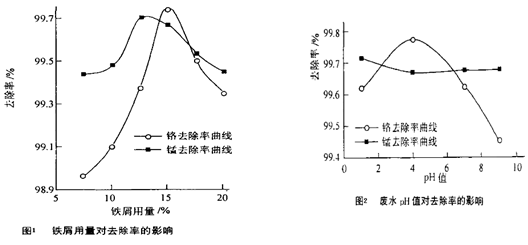
碳化钛(TiC)、碳化硼(B4C3)、氮化硅(Si3N4)等非氧化物陶瓷是新型无机非金属材料,合成这些物质需在高温条件下进行,在合成它们的过程中必须注意 ( )
A.通入足量氧气 B.避免与氧气接触
C.通入少量氯气 D.通入少量氧气
下列说法中不正确的是 ( )
| A.新型无机非金属材料具有光学特性,具有生物功能、具有电学特性、能承受高温、强度高 |
| B.高温结构陶瓷与金属材料相比具有许多优点,如不怕氧化、密度小等优点 |
| C.光导纤维作为通讯材料有许多优点,但怕腐蚀,铺设也很不方便 |
| D.光导纤维除用于通讯外,还可以用于医疗、信息处理等许多方面 |
、联碱法(候氏制碱法)和氨碱法的生产流程简要表示如下图:
⑴沉淀池中发生反应的化学方程式为_____________________;
⑵X是______,Y是______(填化学式);
⑶从理论上分析,在氨碱法生产过程中_______(填“需要”、“不需要”)补充氨气,从原料到产品,氨碱法总反应过程用化学方程式表示,可写为 ;
⑷根据联碱法中从母液中提取氯化铵晶体的过程推测,所得结论正确是____;
a.常温时氯化铵的溶解度比氯化钠小 b.通入氨气目的是使氯化铵更多析出
c.加入食盐细粉目的是提高Na+的浓度,促进碳酸氢钠结晶析出
⑸相比于氨碱法,指出联碱法的一项优点______________。
工业上生产高氯酸(沸点:90oC)时还同时生产了亚氯酸钠,其工艺流程如下:
(1)冷却过滤的目的是降低NaHSO4的 并分离出NaHSO4晶体。
(2)反应器2中发生反应的离子方程式为 。SO2的作用是作 剂。
(3)循环使用的物质是 。
(4)可以通过蒸馏滤液的方法得到高氯酸的原因可能是 。
(5)工业上用铂作阳极、铜或银作阴极电解盐酸也可制得高氯酸,在阳极区可得到20%的高氯酸。写出阳极的电极反应式(其中盐酸与高氯酸以化学式出现) 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。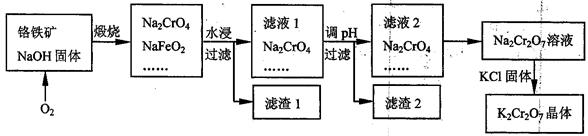 已知:①NaFeO2遇水强烈水解。②Cr2O72-+H2O
已知:①NaFeO2遇水强烈水解。②Cr2O72-+H2O 2CrO42-+2H+
2CrO42-+2H+
请回答:
(1)K2Cr2O7中Cr元素的化合价是 。
(2)生成滤渣1中红褐色物质的反应的化学方程是 。
滤液1的成分除Na2CrO4外,还含有(填化学式) 。
(3)利用滤渣2,可制得两种氧化物,其中一种氧化物经电解冶炼可获得金属,该电解反应的化学方程式是 。
(4)由滤液2转化为Na2Cr2O7溶液应采取的措施是 。
(5)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(15分)氢溴酸在医药和石化工业上有广泛用途。下图是模拟工业制备氢溴酸粗品并精制流程: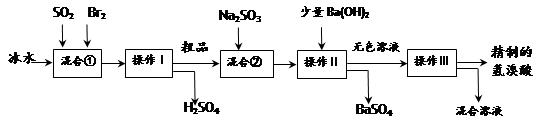
根据上述流程回答下列问题:
(1)混合①中发生反应的化学方程式为 。
(2)混合①中使用冰水的目的是 。
(3)操作Ⅱ和操作Ⅲ的名称分别是 、 。
操作Ⅲ一般适用于分离____________混合物。(选填编号)
a.固体和液体 b.固体和固体 c.互不相溶的液体 d.互溶的液体
(4)混合②中加入Na2SO3的目的是 。
(5)纯净的氢溴酸应为无色液体,但实际工业生产中制得的氢溴酸(工业氢溴酸)带有淡淡的黄色。于是甲乙两同学设计了简单实验加以探究:
甲同学假设工业氢溴酸呈淡黄色是因为含Fe3+,则 用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
用于证明该假设所用的试剂为 ,若假设成立可观察到的现象为 。
乙同学假设工业氢溴酸呈淡黄色是因为________,其用于证明该假设所用的试剂 。
试题篮
()