某工厂用软锰矿(含MnO2约70% 及A12O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2和Zn(干电池原料):
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3、Al2(SO4)3的混合液。
②IV中的电解方程式为
(1)A中属于还原产物的是_____。
(2)加人MnCO3、Zn2(OH)2CO3的作用是_________________;II需要加热的原因是:______ ;C的化学式是_________。
(3)该生产中除得到MnO2和Zn以外,还可得到的副产品是_____。
(4)如果不考虑生产中的损耗,除矿石外,需购买的化工 原料是_______。
(5)要从Na2SO4溶液中得到芒硝(Na2SO4·10H2O),需进 行的操作有蒸发浓缩、 、过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿的质量比大约是____。
Ⅰ.现代工业常以氯化钠为原料制备纯碱,部分工艺流程如下: k+s-5#
k+s-5#
已知NaHCO3在低温下溶解度较小。反应Ⅰ为:NaCl+CO2+NH3+H2O NaHCO3↓+NH4Cl,处理母液的两种方法如下:
NaHCO3↓+NH4Cl,处理母液的两种方法如下:
(1)向母液中加入石灰乳,可将其中________循环利用。
(2)向母液中通入NH3,加入细小的食盐颗粒并降温,可得到NH4Cl晶体。试写出通入NH3后,溶解度较小的酸式碳酸盐转变为溶解度较大的碳酸盐的离子方程式 _____________________________。
Ⅱ.某化学小组模拟“侯氏制碱法”,以NaCl、NH3、CO2和水等为原料以及下图所示装置制取NaHCO3,然后再将NaHCO3制成Na2CO3。
(1)装置丙中冷水的作用是 ;
(2)由装置丙中产生的NaHCO3制取Na2CO3时,需要进行的实验操作有_______、洗涤、灼烧。NaHCO3转化为Na2CO3的化学方程式为 ;
(3)若在(2)中灼烧的时间较短,NaHCO3将分解不完全,该小组对一份加热了t1 min的NaHCO3 样品的组成进行了以下探究。取加热了t1 min的NaHCO3样品29.6 g完全溶于水制成溶液,然后向此溶液中缓慢地滴加稀盐酸,并不断搅拌。随着盐酸的加入,溶液中有关离子的物质的量的变化如图所示。则曲线a对应的溶液中的离子是___________(填离子符号下同);曲线c对应的溶液中的离子是___________;该样品中NaHCO3和Na2CO3的物质的量之比是 ;
(4)若取21.0 g NaHCO3固体,加热了t2 rnin后,剩余固体的质量为l4.8 g。如果把此剩余固体全部加入到200 mL 2 mol•L—1的盐酸中,则充分反应后溶液中H+ 的物质的量浓度为____________(设溶液体积变化忽略不计)
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下溶解平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s) 2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
2Ca2++2K++Mg2++4SO42-+2H2O。为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有________和CaSO4以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:
。
(3)“除杂”环节中,先加入 溶液,经搅拌等操作后,过滤,再加入 溶液调滤液pH至中性。
(4)不同温度下,K+的浸出浓度与溶浸时间的关系见右图。由图可得,随着温度升高,
① ,
② ,
③溶浸出的K+的平衡浓度增大。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+CO32- CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K= 。
CaCO3(s)+SO42-。已知298 K时,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.90×10-5,计算此温度下该反应的平衡常数,K= 。
某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:
已知:[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
| A.气体X中含有SO2 |
| B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可 |
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O CuO + 2HCl↑+ 4NH3↑ CuO + 2HCl↑+ 4NH3↑ |
| D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |
白铁皮(镀锌铁皮)常用于制造屋面、卷管和各种容器,利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:
已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用是____________。
a.去除油污 b.溶解镀锌层 c.去除铁锈 d.钝化
(2)为获得Fe3O4胶体粒子,溶液B中必须含有一定量的Fe2+,可利用________检验其是否存在。
a.NaOH溶液 b.KSCN溶液 c.溶液KMnO4 d.氯水
(3)由溶液B制备Fe3O4胶体粒子的过程中,必须持续通入N2以保证产品的纯度,其原因是_____________ .
(4)在工业上常用水热法制造Fe3O4胶体粒子,有利于提高其纯度和磁性能,主要反应过程为:Fe2++S2O32-+O2+OH- Fe3O4(胶体)+S4O62-+H2O
Fe3O4(胶体)+S4O62-+H2O
①反应过程中起还原剂作用的微粒是________________;
②若反应过程中产生的Fe3O4(胶体)与S4O62-均为1mol,则参加反应的氧气在标准状况下的体积为____________L。
工业上用软锰矿(主要成分为MnO2)制备高锰酸钾的工艺流程如图所示: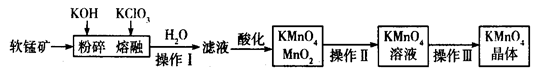
(1)高锰酸钾的氧化性强弱与溶液的酸碱性有关,在酸性条件下其氧化性较强。下列 酸能用于酸化高锰酸钾溶液的是____________(填序号)。
| A.盐酸 | B.稀硫酸 | C.硝酸 | D.氢硫酸 |
(2)操作Ⅰ、Ⅱ、Ⅲ的名称分别是______________、_______________、_______________。
(3)软锰矿与过量固体KOH和KClO3在熔融状态下反应时的氧化剂是__________________(填化学式)。反应后加水溶解得到的滤液中主要含有KCl和K2MnO4,则滤液酸化时发生反应的离子方程式为 _______________________________。
(4)已知KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2。取上述制得的KMnO4产品0.33 g,恰好与0.67 g Na2C2O4完全反应,则KMnO4的纯度为________%。
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质,以此为原料制取的硫酸镁,可用于印染、造纸、医药等工业。从硼镁泥中提取MgSO4·7H2O的工艺流程如下:
已知:NaClO与Mn2+反应产生MnO2沉淀。
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
| 开始沉淀pH |
2.3 |
4.0 |
7.6 |
| 完全沉淀pH |
4.1 |
5.2 |
9.6 |
根据题意回答下列问题:
(1)实验中需用1.00mol/L的硫酸80.0mL,若用98%的浓硫酸配制,除量筒、玻璃棒、胶头滴管外,还需要的玻璃仪器有 、 。
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3外,还有 、 。
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式: 。
在调节pH=5~6之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为:
。
(4)为了检验滤液中Fe3+是否被除尽,可选用的试剂是 。
A.KSCN溶液 B.淀粉KI溶液 C.H2O2 D.KMnO4稀溶液
(5)已知MgSO4、CaSO4的溶解度如下表:
| 温度(℃) |
40 |
50 |
60 |
70 |
| MgSO4 |
30.9 |
33.4 |
35.6 |
36.9 |
| CaSO4 |
0.210 |
0.207 |
0.201 |
0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明操作步骤 、 。
(6)如果测得提供的硼镁泥的质量为100.0g,得到的MgSO4·7H2O196.8g,则MgSO4·7H2O的产率为 (相对分子质量:MgSO4·7H2O-246 MgO-40)。
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O。
① 该反应中氧化剂和还原剂的物质的量之比是 。
② 研究表明:若反应开始时盐酸浓度越大,则气体产物中Cl2的含量越大,运用氧化还原反应规律分析其原因是 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量相同,从电子守恒的角度解释其原因是 。
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
⑴写出浸取过程中Cu2S溶解的离子方程式:____________________。
⑵回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
⑶气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为___________________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
⑷保温除铁过程中,加入CuO的目的是________________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是___________________________。
黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下:
(1)溶液X是________。
(2)检验滤液中是否存在K+的操作是________________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为___________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是____________________。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是_________________。
⑷本流程中可以循环利用的物质除锌外还有________________。
活性Fe3O4为黑色固体,有磁性,其不溶于水、碱和酒精、乙醚等有机溶剂中, Fe3O4在潮湿的空气中或高温下易被O2氧化。工业上利用锈蚀废铁为原料,利用共沉淀法制备活性Fe3O4(或写为FeO·Fe2O3)的流程如下:
(1)在制备过程中将块状固体原料粉碎磨成粉末,作用是 。
(2)设计合理的实验方案证明Fe3O4与盐酸反应的产物中含有Fe2+、Fe3+,简述实验操作步骤和实验现象 。
(可供选择的试剂:KSCN溶液、还原铁粉、氯水、酸性高锰酸钾溶液)
(3)假如在反应池中几乎没有气体产生,在合成池里所有铁元素转化为Fe3O4,则根据相关反应可知,配料中心很可能使混合物中的Fe2O3与Fe物质的量之比接近于 。
(4)在一次制备Fe3O4的实验中,由于配料中心反应物比例控制不当,获得了另一种产品FexOy。取一定量该产品溶于足量盐酸中,还需通入标准状况下224 mLCl2才能把溶液中的Fe2+全部氧化为Fe3+,然后把所得溶液滴加足量NaOH溶液,将沉淀过滤、洗涤、蒸干,灼烧至恒重,得8 g固体。计算该产品的化学式。(请写出计算过程)
孔雀石主要含Cu2(OH)2CO3,还含少量铁的化合物和硅的化合物。以孔雀石为原料可制备CuCl2·3H2O及纯碱,流程如图所示。
已知:溶液A只含Cu2+、Fe2+、Fe3+三种金属离子,且三种离子沉淀时的pH如表所示。回答下列问题。
| 金属离子 |
Fe3+ |
Fe2+ |
Cu2+ |
|
| pH |
氢氧化物开始沉淀 |
1.9 |
7.0 |
4.7 |
| 氢氧化物安全沉淀 |
3.2 |
9.0 |
6.7 |
(1)E、H的化学式依次为 、 。
(2)图中“试剂1”若为H2O2,它在流程中的具体作用为 。
(3)加入CuO的作用是调节溶液pH,则pH的范围为 。
(4)由溶液C获得CuCl2·3H2O,需要经过蒸发浓缩、 、过滤、洗涤、干燥等操作,洗涤CuCl2·3H2O晶体需要的主要玻璃仪器有烧杯、 。
SO2通过下列工艺流程可制化工业原料H2SO4和清洁能源H2。
下列说法中正确的是
| A.电解槽中也可以用铁电极代替石墨作为阳极 |
| B.原电池中负极的电极反应为:SO2+2H2O+4e-=SO42-+4H+ |
| C.该工艺流程用总反应的化学方程式表示为:SO2+Br2+2H2O=2HBr+H2SO4 |
| D.该生产工艺的优点Br2被循环利用,原电池产生的电能可充分利用,还能获得清洁能源 |
焦亚硫酸钠(Na2S2O5)常用作食品漂白剂。其制备工艺流程如下:
已知:反应Ⅱ包含2NaHSO3 Na2S2O5+H2O等多步反应。
Na2S2O5+H2O等多步反应。
(1)实验室制取氨气的化学方程式: 。
(2)反应I的化学方程式为: 。
(3)“灼烧”时发生反应的化学方程式: 。
(4)已知Na2S2O5与稀硫酸反应放出SO2,其离子方程式为: 。
(5)副产品X的化学式是 。
(6)为了减少产品Na2S2O5中杂质含量,需控制反应Ⅱ中气体与固体的物质的量之比约为 。检验产品中含有碳酸钠杂质所需试剂是 (填编号)
①酸性高锰酸钾 ②品红溶液 ③澄清石灰水
④饱和碳酸氢钠溶液 ⑤NaOH ⑥稀硫酸
试题篮
()