用霞石岩(主要成份Na2O、K2O、Al2O3、SiO2)制碳酸钠、碳酸钾和氧化铝的工艺流程如下:
已知:NaHCO3溶液的pH约为8~9,Na2CO3溶液的pH约为11~12。
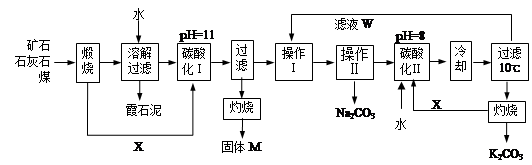
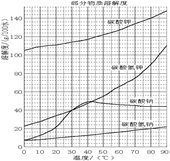
溶解过滤工序产生的滤液中含钠、钾和铝的可溶性盐类,钙和硅等其他杂质在滤渣霞石泥中。部分物质的溶解度见图,根据题意回答下列问题:
固体M的化学式是__________, X物质是___________。
实验室进行煅烧操作时盛放固体物质的实验仪器是 __________,滤液W中主要含有的离子有__________________。
碳酸化Ⅰ中发生主要反应的离子方程式是_______________________________________。
操作Ⅰ是_________(填写名称),操作Ⅱ是 _______(选填编号)。
a.趁热过滤 b.冷却过滤 c.蒸馏 d.灼烧
碳酸化Ⅱ调整pH=8的目的是____________________,产品K2CO3中最可能含有的杂质是________(写化学式)。
实验室用下面流程测定产品碳酸钾的纯度,为提高实验精度,T试剂最好是____________;操作Ⅲ的名称是_______________。
[化学一化学与技术]
金属钛(Ti)因为具有许多神奇的性能越来越引起人们的关注,被誉为“未来金属”。常温下钛不和非金属、强酸反应,加热至红热时,能与常见的非金属反应。工业上由钒钛磁铁矿经“选矿”得到的钛铁矿(主要成分为FeTiO3)制取金属钛的主要工艺过程如下:
(1)从金属矿石中提炼金属一般需要经过三个阶段,上述工艺溶度积中涉及的有矿石中金属元素的还原、矿石的富集、金属的精炼;没有涉及的一个阶段是______________;生铁实际上属于铁______等元素形成的合金。若生产中碳的氧化产物主要为一种可燃性气体,请写出反应②的化学方程式__________________________。
(2)生产中碳除了用还原剂还原还原金属矿物外,还有一个重要作用是______________;反应③是在氩气的环境中进行,目的是_____________________,如何从反应③后的固体中获得金属钛_______________________________。
(3)已知在氯化过程中还有一种副产物VOCl3生成,实际生产中常在409K时用铜还原VOCl3,得到不溶于TiCl4的VOCl2,当有1molCu参加反应时转移的电子数为NA,试写出该反应的化学方程式为___________________。
工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如下:
(1)气体A中的大气污染物可选用下列试剂中的_______吸收。
a.浓H2SO4 b.稀HNO3 c.NaOH溶液 d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,检验溶液中是否含有Fe3+的方法是_____________________________(注明试剂、现象)。若检验溶液中还存在Fe2+的方法是__________(注明试剂、现象),写出反应的离子方程式:____________________________
己知:Ksp [Fe(OH)3]= 4.0×10-38, 若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH为5,此时Fe3+的浓度
(3)由泡铜冶炼粗铜的化学反应方程式为 。
(4)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 。
a.CuSO4溶液的浓度不变 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
精炼后电解质溶液中的阳离子有:_____________________________________
(5)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为 。
(12分)双氧水、过硫酸钾是工业上常用的氧化剂、消毒剂。工业上以铂为阳极,铅或石墨为阴极,电解NH4HSO4溶液得过硫酸铵【(NH4)2S2O8】溶液,其工艺流程为:
(1)将电解后的溶液送往水解器中在减压条件下水解、蒸馏、浓缩分离,精馏得过氧化氢的水溶液,剩余溶液再循环使用。
①写出电解NH4HSO4溶液的化学方程式
②写出水解器中(NH4)2S2O8溶液的水解方程式 。
③铂价格昂贵,试分析电槽阳极用铂不用铅的原因 。
④试分析水解器中使用减压水解、蒸馏的原因 。
(2)在电解后的过硫酸铵溶液中加入硫酸氢钾,析出过硫酸钾固体,过硫酸钾具有强氧化性,常被还原为硫酸钾,80℃以上易发生分解。
①将0.40 mol过硫酸钾与0.20 mol硫酸配制成1 L溶液,在80 ℃条件下加热并在t时刻向溶液中滴加入少量FeCl3溶液,测定溶液中各成分的浓度如右图所示(H+浓度未画出)。图中物质X的化学式为 。
②已知硫酸锰(MnSO4)和过硫酸钾(K2S2O7)两种盐溶液在银离子催化下可发生反应,得到紫红色溶液。此反应的离子反应方程式 .
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)工业上常用一定浓度的纯碱溶液清洗铁屑,目的是 。
(2)加入少量NaHCO3的目的是调节溶液的pH至 a,a的范围是 。
(3)已知室温下,Al(OH)3的Ksp=1.3×10-33,当pH=5时,溶液中c(Al3+)=
(4)在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2有11.2L(标准状况),则相当于节约NaNO2的物质的量为 ;O2参与反应的离子方程式为
(5)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁(碱式硫酸铁的聚合物)和绿矾(FeSO4·7H2O),过程如下: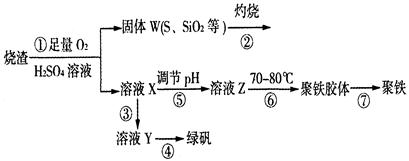
(1)将过程②中的产生的气体通入下列溶液中,溶液会褪色的是 ;
A.品红溶液 B.紫色石蕊溶液 C.酸性KMnO4溶液 D.溴水
(2)过程①中,FeS和O2、H2SO4反应的化学方程式为: ;
(3)过程③中,需加入的物质是 ;
(4)过程④中,蒸发结晶需要使用酒精灯、三角架、泥三角,还需要的仪器有
;
(5)过程⑤调节pH可选用下列试剂中的 (填选项序号);
A.稀硫酸 B.CaCO3 C.NaOH溶液
(6)过程⑥中,将溶液Z加热到70一80℃,目的是 ;
(7)实验室为测量所得到的聚铁样品中铁元素的质量分数,进行下列实验。①用分析天平称取2.00g样品;②将样品溶于足量的盐酸后,加入过量的氯化钡溶液;③过滤、洗涤、干燥,称量,得固体质量为2.33g。若该聚铁主要成分为[(Fe(OH)(SO4)]n,则该聚铁样品中铁元素的质量分数为 。(假设杂质中不含铁元素和硫元素)。
云南省曲靖的铬渣污染经媒体报道后,铬污染再次引起人们的关注。利用化学原理可以对工厂排放的含铬废水、铬渣等进行有效处理。
I.含铬废水的处理:某企业排放的含铬废水中含有较多毒性较大的Cr2O72-,某研究性学习小组为了变废为宝,将废水处理得到金属铬,设计了如下的工艺流程。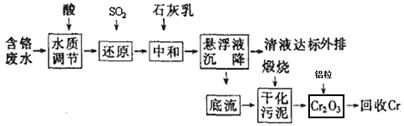
(1)加酸调节到pH=6,则用pH试纸测定溶液pH的操作是: 。
。
(2)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O 2CrO42-+2H+,请写出该平衡的平衡常数表达式k= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式k= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(3)请写出通入SO2时发生的离子反应: 。
(4)写出加入铝粒时发生反应的化学方程式 ,该反应是焓 (填“增加”或“减少”)反应。
II.铬渣的处理
铬渣烧结炼铁法:铬渣中约含有55%的氧化钙和氧化镁,此外还含有15%左右的氧化铁,这些都是炼铁所需的成份。少量的铬渣代替消石灰同铁矿粉、煤粉混合,经烧结后送入高炉冶炼,六价铬还原为三价铬或金属铬,金属铬熔入铁水,而其它成分熔入熔渣。炼铁可使铬渣彻底解毒并充分利用,是铬渣治理的良好方法之一。
碱性溶液还原法:直接在碱性铬渣中加入硫化钠等进行六价铬的还原反应,形成Cr(OH)3沉淀后,过滤回收铬污泥。
(5)铬渣烧结炼铁法中煤粉的作用是 。(写两点)
(6)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2—+□H2O=□Cr(OH)3+□S2O32—+□OH—
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2.2H2O,工艺流程如下: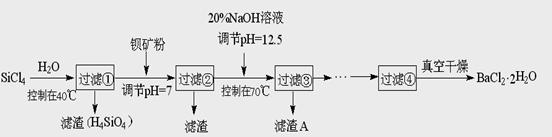
已知:
①常温下Fe3+、Mg2+完全沉淀的PH分别是3.4、12.4
②BaCO3的相对分子质量是197;BaCl2.2H2O的相对分子质量是244
回答下列问题:
⑴SiCl4发生水解反应的化学方程式_______________________________________
⑵SiCl4用H2还原可制取纯度很高的硅,当反应中有1mol电子转移时吸收59KJ热量,则该反应的热化学方程式为_____________________________________________
⑶加钡矿粉调节PH=7的作用是①使BaCO3转化为BaCl2 ②_______________________
⑷生成滤渣A的离子方程式__________________________________________
⑸BaCl2滤液经______、________、过滤、_________,再经真空干燥后得到BaCl2.2H2O
⑹10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2.2H2O___________吨。
(8分)亚氯酸钠(NaClO2)是一种重要的消毒剂。已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,②ClO2的沸点为283K,纯ClO2易分解爆炸,③HClO2在25℃时的电离程度与硫酸的第二步电离程度相当,可视为强酸。如图是过氧化氢法生产亚氯酸钠的工艺流程图:
(1)C1O2发生器中所发生反应的离子方程式为 ,发生器中鼓入空气的作用可能是 (选填序号)。
A.将SO2氧化成SO3增强酸性
B.稀释C1O2以防止爆炸
C.将NaClO3氧化成C1O2
(2)在该实验中用质量浓度来表示NaOH溶液的组成,若实验时需要450mLl60g/L的NaOH溶液,则在精确配制时,需要称取NaOH的质量是 g,所使用的仪器除托盘天平、量筒、烧杯、玻璃棒外,还必须有
(3)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量所需要的试剂是
(4)在吸收塔中,可代替H2O2的试剂是 (填序号)。
A.Na2O2 B.Na2S C.FeCl2 D.KMnO4
(5)从滤液中得到NaClO2·3H2O晶体的实验操作依次是 (填操作名称)
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图。
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式:
▲ 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是:
▲ 。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为: ▲ 。温度对GeCl4的水解率产生的影响如右图所示。为控制最佳的反应温度,实验时可采取的措施为 ▲ 。(填字母)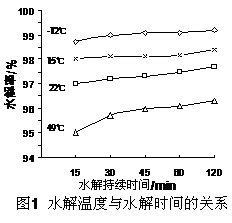
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)根据下表1 中不同pH下二氧化锗的溶解率,结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ▲ ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 ▲ 。
表1 不同pH下二氧化锗的溶解率
| pH |
4 |
5 |
6 |
7 |
8 |
9 |
| 溶解率/% |
47.60 |
32.53 |
11.19 |
5.27 |
1.96 |
8.85 |
试题篮
()