人们在日常生活中大量使用各种高分子材料,下列说法正确的是
| A.天然橡胶易溶于水 | B.羊毛是合成高分子材料 |
| C.聚乙烯塑料是天然高分子材料 | D.聚氯乙烯塑料会造成“白色污染” |
.硫酸钙是一种用途非常广泛的产品,可用于生产硫酸、漂白粉等一系列物质(见图3)。下列说法正确的是
图3
| A.CO、SO2、SO3均是酸性氧化物 |
| B.工业上利用Cl2和澄清石灰水反应来制取漂白粉 |
| C.除去与水反应,图3所示转化反应均为氧化还原反应 |
| D.用CO合成CH3OH进而合成HCHO的两步反应,原子利用率均为100% |
下列金属防护属于电化学保护的是( )
| A.改变金属内部组成结构,可以增强金属耐腐蚀的能力 | B.涂油漆 |
| C.外加电流阴极保护法 | D.在金属表面覆盖一层保护层 |
世界著名的科技史专家、李约瑟博士考证说:“中国至少在距今3000年以前,就已经使用玻璃了。”下列有关玻璃的说法不正确的是:
| A.制普通玻璃的原料主要是纯碱、石灰石和石英 |
| B.普通玻璃的成分主要是硅酸钠、硅酸钙和二氧化硅 |
| C.玻璃在加热熔化时有固定的熔点 |
| D.盛放烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱跟二氧化硅生成硅酸钠而使瓶塞与瓶口黏在一起 |
【化学——选修2:化学与技术】碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下: 
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓) Li2SO4+Al2O3·H2O↓
Li2SO4+Al2O3·H2O↓
②某些物质的溶解度(S)如下表所示。
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。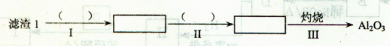
则步骤I中反应的离子方程式是 ,步骤Ⅱ应通入一种气体试剂为 ,步骤II反应完之后需要的操作是 。
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液l中加入石灰乳的作用是(用离子方程式表示) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过 量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
下列与化学有关的说法中正确的是
| A.高温结构陶瓷和光导纤维均属新型无机非金属材料 |
| B.风力发电和火力发电均能将化学能转化为电能 |
| C.二氧化碳和氮气均是造成温室效应的气体 |
| D.煤的干馏与石油的分馏均属于化学变化 |
材料与化学密切相关,表中对应关系不正确的是
| |
材料 |
主要化学成分 |
| A. |
陶瓷餐具 |
硅酸盐 |
| B. |
计算机芯片 |
晶体硅 |
| C. |
合金钢 |
铁碳铬硅等合金 |
| D. |
金刚砂 |
二氧化硅 |
下列有关金属的工业制法中,正确的是
| A.制钛:用金属钠置换氯化钛(TiCl4)溶液中的钛 |
| B.炼铁:用焦炭和空气反应产生的CO在高温下还原铁矿石中的铁 |
| C.制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液 |
| D.炼铜:用黄铜矿(主要成分为CuFeS2)直接电解精炼得到纯度为99.9%的铜 |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。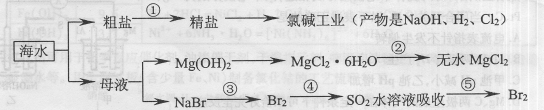
下列有关说法正确的是 ( )
| A.在工段③和⑤中需要用到氯碱工业的产物 |
| B.工段②中的MgCl2·6H2O可在空气中受热分解制无水MgCl2 |
| C.大量的含Fe3+废水排人海洋,易引发赤潮 |
| D.工段①中除去粗盐中的SO42-、Ca2+、Mg2+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液一过滤后加盐酸 |
碳化钛(TiC)、碳化硼(B4C3)、氮化硅(Si3N4)等非氧化物陶瓷是新型无机非金属材料,合成这些物质需在高温条件下进行,在合成它们的过程中必须注意 ( )
A.通入足量氧气 B.避免与氧气接触
C.通入少量氯气 D.通入少量氧气
下列说法中不正确的是 ( )
| A.新型无机非金属材料具有光学特性,具有生物功能、具有电学特性、能承受高温、强度高 |
| B.高温结构陶瓷与金属材料相比具有许多优点,如不怕氧化、密度小等优点 |
| C.光导纤维作为通讯材料有许多优点,但怕腐蚀,铺设也很不方便 |
| D.光导纤维除用于通讯外,还可以用于医疗、信息处理等许多方面 |
工业以CaO和硝酸反应制Ca(NO3)2·4H2O晶体,为确保制备过程既不补充水分,又无水剩余,则应选用的硝酸质量分数为
| A.30% | B.63% | C.70% | D.84% |
试题篮
()