工业上以锂辉石(Li2O·A12O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2 +H2SO4(浓) Li2SO4+Al2O3·4SiO2·H2O↓
Li2SO4+Al2O3·4SiO2·H2O↓
②某些物质的溶解度(S)如下表所示。
| T/℃ |
20 |
40 |
60 |
80 |
| S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
| S(Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣1中分离出Al2O3的部分流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅱ中最佳反应的离子方程式是____________________________。
(2)已知滤液1中的主要离子为Li+、Mg2+、Ca2+、SO42-,滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述,并写离子方程式)
__________________________________________________________________。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
① a中,阳极的电极反应式是______________________________________。
②b中,生成Li2CO3反应的化学方程式是______________________________。
NiSO4·6H2O是一种绿色易溶于水的晶体,广泛用于化学镀镍、生产电池等,可由电镀废渣(除含镍外,还含有:Cu、Zn、Fe、Cr等杂质)为原料获得。操作步骤如下:
(1)加Na2S的目的是除去铜、锌等杂质,请写出除去Cu2+的离子方程式__________ __________
(2) 加6%的H2O2时,温度不能过高,其目的是: _____ ________ 。
(3) 除铁方法:用H2O2充分氧化后,再用NaOH控制pH值2~4范围内生成氢氧化铁沉淀。在上述方法中,氧化剂可用NaClO3代替,请写出用氯酸钠氧化Fe2+的离子方程式为:______________________________________________________
(4)上述流程中滤液Ⅲ的主要成分是: 。
(5)操作Ⅰ包括以下过程:过滤,用 (填试剂化学式)溶解,蒸发浓缩,冷却结晶,洗涤获得产品。
以富含硫酸亚铁的工业废液为原料生产氧化铁的工艺如下(部分操作和条件略):
Ⅰ.从废液中提纯并结晶出FeSO4·7H2O。
Ⅱ.将FeSO4·7H2O配制成溶液。
Ⅲ. 溶液与稍过量的
溶液与稍过量的 溶液混合,得到含FeCO3的浊液,同时有CO2气体放出。
溶液混合,得到含FeCO3的浊液,同时有CO2气体放出。
Ⅳ.将浊液过滤,用90℃热水洗涤沉淀,干燥后得到FeCO3固体。
Ⅴ.煅烧FeCO3,得到FeCO3固体。
已知:NH4HCO3在热水中分解。
(1)Ⅰ中,加足量的铁屑除去废液中的 ,该反应的离子方程式是 。
,该反应的离子方程式是 。
(2)Ⅱ中,需加一定量硫酸。运用化学平衡原理简述硫酸的作用 。
(3)Ⅲ中,生成 的离子方程式是 。若
的离子方程式是 。若 浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
浊液长时间暴露在空气中,会有部分固体表面变为红褐色,该变化的化学方程式是 。
(4)Ⅳ中,通过检验 来判断沉淀是否洗涤干净。检验
来判断沉淀是否洗涤干净。检验 的操作是 。
的操作是 。
(5)已知锻烧 的化学方程式是
的化学方程式是

 。现锻烧464.0kg的
。现锻烧464.0kg的 ,得到316.8kg产品。若产品中杂质只有
,得到316.8kg产品。若产品中杂质只有 ,则该产品中
,则该产品中 的质量是 kg。
的质量是 kg。
(15分) 铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下:
① 沉淀 A、B的成分分别是 、 ;步骤②中的试剂a是 ;
② 试写出步骤③中发生反应的离子方式 __________ 、
__________ __________ ;
③试写出步骤③中滤液分解反应的方程式____________________________________.
④简述氯化铝溶液经过结晶得到氯化铝晶体的实验条件是 。
甲烷是天然气、沼气、坑气及煤气的主要成分之一,可用作燃料及制造氢、一氧化碳、甲醛等物质的原料,其中用作制氢合成氨的工艺流程示意图如下:
依据上述流程,完成下列填空:
(1)天然气脱硫时的化学方程式是_______________________________。
(2)n mol CH4经一次转化后产生CO 0.9n mol,产生H2_____________mol,假设后面几步转化各物质均完全反应,则理论上可制备得到氨气 mol(用含n的代数式表示)
(3)K2CO3(aq)和CO2反应在加压下进行,加压的理论依据是___________
A.相似相容原理 B.勒夏特列原理 C. 酸碱中和原理
(4)分析流程示意图回答,该合成氨工艺主要起始原料是 ,辅助原料有_________。
(5)整个流程有三处循环,一是Fe(OH)3循环,二是 循环,三是N2、H2循环。
某厂用含有少量杂质FeCl2的CuCl2溶液制备纯净的CuCl2·2H2O晶体, 为降低成本且不造成空气污染,拟定实验步骤如下:
一些金属氢氧化物沉淀的PH
| 金属离子 |
PH |
|
| 开始沉淀 |
沉淀完全 |
|
| Fe2+ |
7.6 |
9.6 |
| Fe3+ |
2.7 |
3.7 |
| Cu2+ |
4.4 |
4.6 |
化学试剂价格表
回答下列问题:
(1)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的________(填字母)。
A.H2O2 B.NaClO C.KOH D.Cl2
该反应的离子方程式为____________________________________________。
(2)在步骤Ⅱ中,①加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以选用下列物质中的________________(填字母);
A.NaOH B.CuO C.Cu(OH)2 D.Cu2(OH)2CO3
②江河入海口处易形成沙洲的原因是江水中的胶粒遇海水中的电解质发生聚沉。将步骤Ⅱ中沉淀经过适当步骤制成胶体后,再逐滴加入稀硫酸可能看到的现象是_________。
(3)步骤Ⅲ应控制的实验条件是 ________________________ 。
某炼铁废渣中含有大量CuS及少量铁的化合物(铁元素的化合价为+2和+3价),工业上以该废渣为原料生产CuCl2的工艺流程如下:
焙烧过程中发生的主要反应为:CuS+2NaCl+2O2高温CuCl2+Na2SO4。
回答下列问题:
(1)焙烧前先进行粉碎的理由是_____________________________________________。
(2)试剂A应选用 (填编号)①NaClO、②Cl2、③H2O2溶液、④浓硫酸
加入试剂A的目的是____________________________________________________________。
(3)上述过滤操作中需要用到的玻璃仪器有_____________________________________________。
(4)从CuCl2溶液得到CuCl2晶体的操作是 (写出操作名称),该操作必需在HCl气流中进行,原因是_____________________________________________(用离子方程式表示)。
(5)如何检验滤液B中是否还有未沉淀的Fe3+______________________________,
加试剂A调节溶液pH=4时,c(Fe3+)为_______________。(已知Ksp[Fe(OH)3]=2.6×10-39)
(共12分) 工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:① Li2O·Al2O3·4SiO2 H2SO4(浓)
H2SO4(浓) Li2SO4
Li2SO4 Al2O3·4SiO2·H2O↓
Al2O3·4SiO2·H2O↓
② 某些物质的溶解度(S)如下表所示:
| T/℃ |
20 |
40 |
60 |
80 |
 (Li2CO3)/g (Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
 (Li2SO4)/g (Li2SO4)/g |
34.2 |
32.8 |
31.9 |
30.7 |
③ 从滤渣1中分离出Al2O3的部分流程如下图所示:
(1)、请依次写出在括号内加入试剂的化学式 、 。
(2)、请依次写出方框中所得到物质的化学式 、 。
(3)、步骤Ⅰ中反应的离子方程式是 。
(4)、已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(5)、向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是
。
(6)、氧化铝在工业上用作高温耐火材料,制耐火砖、坩埚、瓷器、人造宝石等,同时氧化铝也是炼铝的原料。写出用氧化铝炼铝的化学方程式: 。
钯(Pd)的性质与铂相似。工业上从废催化剂(主要成分是钯和活性炭,还含有少量铁、锌)中回收钯,采用如下流程:
请回答下列问题:
(1)酸溶I的目的是__________________________________。
(2)①酸溶Ⅱ时残渣与王水在加热条件发生的主要反应是:
3Pd +12HCl + 2HNO3  3H2PdCl4 + 2NO↑+ 4H2O
3H2PdCl4 + 2NO↑+ 4H2O
写出催化剂中另一主要成分与浓硝酸反应的化学方程式:_________________。
②酸溶Ⅱ需控制温度不宜过高,除了控制一定反应速率外,其原因可能还有
_____________________________。
③若用足量的烧碱吸收气体,请写出吸收后溶液中含有的溶质的化学式:NaOH、NaNO2、___________、___________。
(3)使用甲醛还原钯的化合物时,溶液须保持碱性,否则会造成甲醛的额外损耗,原因是_______________________________________。
(4)操作I的名称是_______________,溶液I可能含有的有机离子为________________。
(5)有人提出,在进行酸溶前最好先将废催化剂在700℃下进行灼烧,同时不断通入空气,
其目的是______________________________________________________。
高铁酸盐在能源、环保等方面有着广泛的用途。湿法、干法制备高铁酸盐的原理如下表所示。
湿法:强碱性介质中,Fe(NO3)3与NaClO反应生成紫红色高铁酸盐溶液
干法:Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物
(1)工业上用湿法制备高铁酸钾(K2FeO4)的流程如下图所示:
①反应I的化学方程式为 。
②反应II的离子方程式为 。
③加入饱和KOH溶液的目的是 。
(2)高铁酸钾是一种理想的水处理剂,其处理水的原理为 ; ______ ____。
(3)干法制备K2FeO4的反应中,氧化剂与还原剂的物质的量之比为 。
(14分)某学生实验小组拟用孔雀石(主要成分是Cu(OH)2·CuC03,其杂质主要为FeC03等)制胆矾,实验设计流程如下:
回答下列问题:
(1)步骤(a)中,实验研磨孔雀石的仪器名称 ;用硫酸浸取的化学方程式:
(2)步骤(b)中,pH控制在3.O~3.5,其目的是 ;加过氧化氢发生反应的离子方程式为 。
(3)怎样判断蒸发浓缩已完成: 。
(4)将制得的样品用热重仪进行热重分析,热重仪原理及热重记录如下表: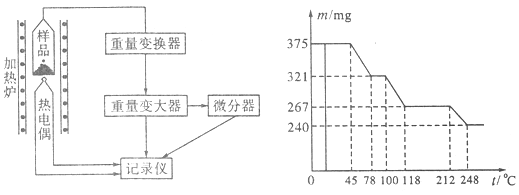
写出212~248℃温度范围内发生反应的化学方程式 。
(5) FeC03为白色沉淀,此沉淀的Ksp(FeC03)=2×10-11,将FeCl2的稀溶液与Na2CO3溶液等体积混合,若FeCl2的浓度为2×lO一5mol·L-1.则生成沉淀所需Na2CO3溶液的最小浓度为 mol·L-1。
利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为:
请回答:
(1)过程①主要反应的离子方程式为 。
(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39。
当溶液中某离子浓度不高于1×10-5 mol·L-1时,可以认为该离子已经完全沉淀。通过计算所得数据说明过程②调节pH=9的原因是 。
(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56∶1∶32,则过程③主要反应的化学方程式为 。
(4)已知Fe2+在弱碱性溶液中还原性较强,图11是研究过程④的实验所得,则该反应所需的时间控制在 小时左右,较为适宜。
(5)某工厂处理废铁泥(测得铁元素含量为16.8 %)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时。如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为 千克。
铬酸铅俗称铬黄,不溶于水。广泛用于涂料、油墨、漆布、塑料和文教用品等工业。实验室模拟工业上用铬污泥(含有Cr2O3、Fe2O3、Al2O3、SiO2等)制备铬黄的工艺流程如下:
(1)将铬污泥粉碎的目的是 。操作a的名称为 。
(2)废渣的主要成分是Al(OH)3和Fe(OH)3。已知25℃时,Al(OH)3的Ksp=1.3×10—33,则该温度下反应Al3+ + 3H2O  Al(OH)3 +3H+的平衡常数为 。
Al(OH)3 +3H+的平衡常数为 。
(3)写出加入30%H2O2过程中发生的离子反应方程式: 。
(4)加入Pb(NO3)2沉淀CrO42—时,检验沉淀是否完全的方法是 。
(5)在废液中加入10%明矾溶液发生反应的化学方程式为 。
碳酸锶广泛应用于电子工业。以天青石(主要成分为SrSO4)为基本原料制备碳酸锶。
(1)碳还原法制备。
①已知:SrSO4(s) + 4C(s) 4CO(g) + SrS(s) △H=+a kJ·mol-1
4CO(g) + SrS(s) △H=+a kJ·mol-1
SrSO4(s) + 2C(s) 2CO2(g) + SrS(s) △H=+b kJ·mol-1
2CO2(g) + SrS(s) △H=+b kJ·mol-1
则:反应C(s) + CO2(g) 2CO(g)的△H= ___________kJ·mol-1。
2CO(g)的△H= ___________kJ·mol-1。
②SrS是强碱弱酸盐,热水中发生水解的化学反应方程式为_______________________。
③水解所得Sr(OH) 2与NH4HCO3按照物质的量比1:1投料制备SrCO3,则化学反应方程式为__________________________________________________。
(2)湿法制备。(已知:Ksp(SrSO4)=3.2×10-7,Ksp(SrCO3)=1.1×10-10。)
①将天青石矿粉与Na2CO3溶液搅拌混匀、加热,发生的离子反应方程式为: ____________。
②当转化完成时,混合液中c(CO32-)= 1.0×10-3mol/L,c(SO42-)=______________mol/L。
菱锰矿的主要成分是碳酸锰,还含 Fe2O3、FeO、CaO、MgO 等成分。某化工厂用废盐酸(质量分数约20%)与菱锰矿制备MnCl2·4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水而成无水物),部分工艺流程如下:
(1)废盐酸与菱镁矿中碳酸锰反应的化学方程式为:_______________________________。
(2)酸浸时,浸出时间对锰浸出率的影响如右图,工业采用的是浸取60min,其可能原因是:____________________________________________________。
(3)图中“净化剂X”可能是________________________。
(4)过滤4获得的盐Y,其主要成分是__________________________。
(5)浓缩结晶时,必须一出现晶膜立刻停止加热,其原因是:_______________________。
试题篮
()