工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH) 2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
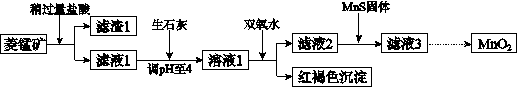
已知: 生成氢氧化物沉淀的pH
| |
Mn(OH)2 |
Fe(OH)2 |
Fe(OH)3 |
Cu(OH)2 |
| 开始沉淀时 |
8.3 |
6.3 |
2.7 |
4.7 |
| 完全沉淀时 |
9.8 |
8.3 |
3.7 |
6.7 |
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是 。盐酸溶解MnCO3的化学方程式是 。
(2)向溶液1中加入双氧水时,反应的离子方程式是 。
(3)将MnCl2转化为MnO2的一种方法是氧化法。其具体做法是用酸化的NaClO3溶液将MnCl2氧化,该反应的离子方程式为:5Mn2++2ClO3-+□_______=□_______+□_______+□_______。
(4)将MnCl2转化为MnO2的另一种方法是电解法。
① 生成MnO2的电极反应式是 。
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是 。
③ 若在上述MnCl2溶液中加入一定量的Mn(NO3)2粉末,则无Cl2产生。其原因是 。
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下: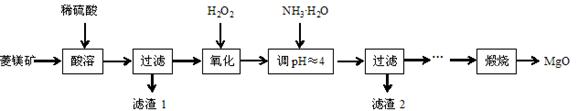
(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2的成分是 (填化学式)。
(4)煅烧过程存在以下反应:
2MgSO4+C  2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C  MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C  MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用下图装置对煅烧产生的气体进行分步吸收或收集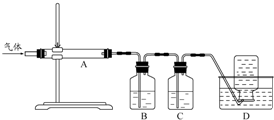
①D中收集的气体是 。
②B中盛放的溶液可以是 。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主 要是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
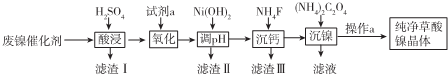
已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 |
Fe3+ |
Fe2+ |
Al3+ |
Ni2+ |
| 开始沉淀的pH |
1.1 |
5.8 |
3.0 |
6.8 |
| 完全沉淀的pH |
3.2 |
8.8 |
5.0 |
9.5 |
②Ksp(CaF2)=1.46×10-10
③当某物质模拟高度小于1.0×10-5mol.L-1时,视为完全沉淀.
(1)请写出一种能提高酸浸速率的措施________________________________。
(2)试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式____________________。
(3)pH的调控范围为_____________,试用化学反应原理的相关知识解释滤渣Ⅱ的生成。
(4)写出“沉镍”时反应的离子方程式______,证明Ni2+已经沉淀完全的实验步骤及现象是________,
(5)操作a的内容为___________。
选考题【化学一一选修化学与技术】以炼锌烟尘(主要成份为ZnO,含少量CuO和FeO)为原料,可以制取氯化锌和金属锌。
Ⅰ、制取氯化锌主要工艺如下: 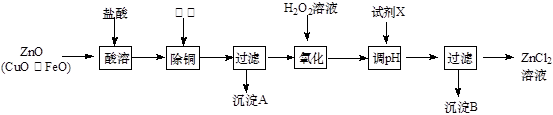
下表列出了相关金属离子生成氢氧化物沉淀的pH (开始沉淀的pH按金属离子浓度为1.0 mol·L-1计算)。
| 金属离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1. 1 |
3. 2 |
| Zn2+ |
5. 2 |
6. 4 |
| Fe2+ |
5. 8 |
8. 8 |
(1)加入H2O2溶液发生反应的离子方程式为 。
(2)流程图中,为了降低溶液的酸度,试剂X不可以是 (选填序号:
a.ZnO;b.Zn(OH)2 ;c.Zn2(OH)2CO3;d.ZnSO4;pH应调整到 ;
(3)氯化锌能催化乳酸(2-羟基丙酸)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为 ,聚乳酸的结构简式为 ;
Ⅱ、制取金属锌采用碱溶解ZnO(s)+2NaOH(aq)+H2O(l)=Na2[Zn(OH)4](aq),然后电解浸取液。
(4)以石墨作电极电解时,阳极产生的气体为 ;阴极的电极反应为 ;
(5)炼锌烟尘采用碱溶,而不采用酸溶后电解,主要原因是 。
工业上用软锰矿(主要成分是二氧化锰)制取高锰酸钾和软磁铁氧体材料MnxO4,其流程如下(部分条件和产物省略):
请回答下列问题:
(1)K2MnO4中锰元素的化合价是___________。
(2)写出粉碎矿石和氢氧化钾熔融物中通入空气时,发生主要反应的化学方程式___________________。
(3)分析下表数据。工业上采用III得到较纯净的高锰酸钾,III中包含的操作名称是________________。
(4)上述工业流程中试剂X的最佳物质是(填化学式)_________________________;设计步骤IV的目的是________________________。
(5)通过煅烧MnSO4·H2O可制得软磁铁氧体材料MnxO4。如图是煅烧MnSO4·H2O时温度与剩余固体质量变化的曲线。该曲线中A段所表示物质的化学式是_____________;MnxO4中x=_________________________。
(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1. 00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X__________________,Y________________。
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________;生产过程中调节溶液的pH不能过大的原因是________________。
(3)写出产生CuCl的化学方程式:______________________。
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_____________。
(15分)三氯氧磷(POCl3)无色液体,易水解。用于制取染料中间体,有机合成的氯化剂和催化剂,阻燃剂。还常用作半导体掺杂剂及光导纤维原料。氯化水解法生产三氯氧磷的流程如下:

(1)在反应釜中氯化水解法生产三氯氧磷的化学方程式为 。反应中应控制氯气和水的质量比为3.94,若质量比过小,会导致三氯氧磷产率降低,试分析原因 。
(2)经吸收塔吸收后得到副产品,副产品为 (写名称)。
(3)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取a g产品于锥形瓶中,加入足量NaOH溶液,待完全水解后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000 mol·L-1的AgNO3溶液40.00 mL,使Cl-完全沉淀。
Ⅲ.向其中加入2 mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用c mol·L-1NH4SCN溶液滴定过量Ag+至终点,记下所用体积。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是 (选填字母),滴定终点的现象为 。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②实验过程中加入硝基苯的目的是 ,如无此操作所测Cl元素含量将会 (填“偏大”、“偏小”或“不变”)
(4)氯化水解法生产三氯氧磷会产生含磷(主要为H3PO4、H3PO3等)废水,某研究小组想把含磷废水中磷元素转化为磷酸钙沉淀除去,实验操作为 。
可选用的试剂:漂白粉 生石灰 氯化
| |
最佳沉淀pH |
| 磷酸氢钙 |
7.0——7.6 |
| 磷酸钙 |
9.0——11 |
CMA(醋酸钙、醋酸镁固体的混合物)是高速公路的绿色融雪剂。以生物质废液——木醋液(主要成分乙酸,以及少量的甲醇、苯酚、焦油等杂质)及白云石(主要成分MgCO3·CaCO3,含SiO2等杂质)等为原料生产CMA的实验流程如下:

(1)步骤①发生的反应离子方程式为 。

(2)步骤②所得滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色的焦油有关外,产生颜色的另一主要原因是 。
(3)已知CMA中钙、镁的物质的量之比与出水率(与融雪效果成正比)关系如图所示,步骤④的目的除调节n(Ca)∶n(Mg)约为 (选填:1∶2;3∶7;2∶3)外,另一目的是 。
(4)步骤⑥包含的操作有 、过滤、洗涤及干燥。
某工厂的电镀污泥中含有铜、铁等金属化合物。为实现资源的回收利用并有效防止环境污染,设计如下工艺流程:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
| 开始沉淀的pH |
2.3 |
7.6 |
4.4 |
| 完全沉淀的pH |
3.2 |
9.7 |
6.4 |
(1)酸浸后加入H2O2的目的是_____________。调pH步骤中加入的试剂最好是_____________(填化学式)。实验室进行过滤操作所用到的玻璃仪器有_____________。
(2)向CuSO4溶液中加入一定量的NaCl、Na2SO3,可以生成白色的CuCl沉淀,写出该反应的化学方程式_____________。
(3)CuCl产品中CuCl的质量分数大于96.50%为国家合格标准。称取所制备的CuCl样品0.2500g置于一定量的0.5mol/LFeCl3溶液中,待样品完全溶解后,加水20mL,用0.1000mol/L的Ce(SO4)2溶液滴定,到达滴定终点时消耗Ce(SO4)2溶液24.60mL。有关的化学反应为: Fe3++CuCl═Fe2++Cu2++Cl-,Ce4++Fe2+═Fe3++Ce3+,通过计算说明该CuCl样品_______________(填“符合”或“不符合”)国家标准。
(4)25℃时,Ksp[Fe(OH]3]=4.0×10-38.Fe3+发生水解反应Fe3++3H2O  Fe(OH)3+3H+,该反应的平衡常数为_____________.
Fe(OH)3+3H+,该反应的平衡常数为_____________.
麦秸杆、木屑等废料经干馏制燃料气过程中产生大量的废液,俗称木醋液(主要成分乙酸,还含少量的甲醇、苯酚、焦油等)。以木醋液与白云石(主要成分2MgCO3·3CaCO3,还含有SiO2等杂质)等为原料,可制备出绿色环保型融雪剂CMA(醋酸钙、醋酸镁固体的混合物)。
CMA生产流程如下:
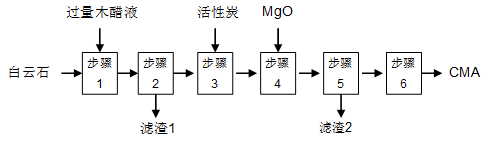
(1)步骤①发生反应的离子方程式为 ________________。
(2)滤渣1的主要成分为 (写化学式);步骤②所得滤液常呈褐色,颜色除与木醋液中含有少量的有色焦油外,产生颜色的另一主要原因是 。
(3)步骤③是往滤液中加活性炭粉,可使滤液脱色,这是利用了活性炭具有 。
实验测知CMA中钙、镁离子的物质的量之比与出水率(与融雪效果成正比)的关系如图。
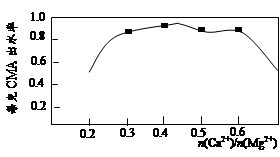
(4)由图知,当CMA中n(Ca2+)∶n(Mg2+)约为 时融雪的效果最好。(选填字母)
a.1∶2 b.3∶7 c.2∶3
步骤④的目的主要是 , 。
(5)步骤⑥包含的操作有 、过滤、洗涤及干燥。
【化学—选修2:化学与技术】普通纸张的主要成分是纤维素。在早期的纸张生产中,常采用纸表面涂明矾的工艺,以填补其表面的微孔,防止墨迹扩散,请回答下列问题:
(1)人们发现纸张会发生酸性腐蚀而变脆、破损,严重威胁纸质文物的保存.经分析检验,发现酸性腐蚀主要与造纸中涂敷明矾的工艺有关,其中的化学原理是______________;为了防止纸张的酸性腐蚀,可在纸浆中加入碳酸钙等添加剂,该工艺原理的化学(离子)方程式为______________;
(2)为了保护这些纸质文物,有人建议采取下列措施:
①喷洒碱性溶液,如稀氢氧化钠溶液或氨水等.这样操作产生的主要问题是______________;
②喷洒Zn(C2H5)2.Zn(C2H5)2可以与水反应生成氧化锌和乙烷.用化学(离子)方程式表示该方法生成氧化锌及防止酸性腐蚀的原理______________;
(3)现代造纸工艺常用钛白粉(TiO2)替代明矾.钛白粉的一种工业制法是以钛铁矿(主要成分为FeTiO3)为原料按下列过程进行的,请完成下列化学方程式:
①______ FeTiO3+____ C+___ Cl2 ____ TiCl4+___ FeCl3+____CO
____ TiCl4+___ FeCl3+____CO
②______ TiCl4+____ O2 ____ TiO2+____ Cl2。
____ TiO2+____ Cl2。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
镍是有机合成的重要催化剂。某化工厂有含镍催化剂废品(主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质)。某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:

几种难溶碱开始沉淀和完全沉淀的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀 |
3.8 |
2.7 |
7.6 |
7.1 |
| 完全沉淀 |
5.2 |
3.2[来 |
9.7 |
9.2 |
回答下列问题:
(1)溶液①中含有金属的离子是 。
(2)用离子方程式表示加入双氧水的目的 。
(3)操作b调节溶液范围为3.2~7.1,其目的是 ,固体②的化学式为 。
(4)操作a和c需要共同的玻璃仪器是 。上述流程中,防止浓缩结晶过
程中Ni2+水解的措施是 。
(5)如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是 。
设计实验证明产品中是否含“杂质”: 。(不考虑硫酸镍影响)
(6)取2.000 g硫酸镍晶体样品溶于蒸馏水,用0.2000 mol•L-1的EDTA(Na2H2Y)标准溶液滴定至终点,消耗EDTA标准溶液为34.50 mL。反应为Ni2++H2Y2-=NiY2-+2H+。计算样品纯度为 。(已知,NiSO4•7H2O相对分子质量为281,不考虑杂质反应)。
硼及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O,还有少量Fe2O3、FeO、CaO、Al2O3和SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:
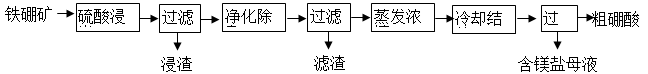
已知:Fe3+、Al3+、Fe2+和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、4.9、9.7和 12.4。
回答下列问题:
(1)为提高“浸出”速率,除适当增加硫酸浓度外,还可采取的措施有 。
(2)实验室中过滤操作所需要的玻璃仪器有:玻璃棒、 。
(3)“浸渣”中的物质是 (化学式)。
(4)“净化除杂”需先加H2O2溶液,作用是 ,然后再调节溶液的pH约为5,目的是 。
(5)“粗硼酸”中的主要杂质是 (填名称)。
(6)单质硼可用于生产具有优良抗冲击性能的硼钢。以硼酸和金属镁为原料在加热条件下可制备单质硼,用化学方程式表示制备过程 。
试题篮
()