常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_____________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该反应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率__ _.
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强.
多晶硅(硅单质的一种)被称为“微电子大厦的基石”,制备中副产物以SiCl4为主,它环境污染很大,能遇水强烈水解,放出大量的热。研究人员利用SiCl4水解生成的盐酸和钡矿粉(主要成分为BaCO3,且含有铁、镁等离子),制备BaCl2 • 2H2O,
工艺流程如下:
已知:①常温下Fe3+、Mg2+ 完全沉淀的pH分别是3.4、12.4;
②BaCO3的相对分子质量是197; BaCl2 • 2H2O的相对分子质量是244;
(1)SiCl4发生水解反应的化学方程式 。
(2)氮化硅(Si3N4)是一种高温结构材料,粉末状的Si3N4可以在高温条件下由SiCl4 蒸
汽与NH3反应得到,请写出该反应的化学方程式 。
(3)加钡矿粉调节pH=7的作用是:
①使BaCO3转化为BaCl2
②_______________________________
(4)生成滤渣A的离子方程式________________________________________
(5)BaCl2滤液经____________________、______________________、过滤、洗涤,再经真空干燥后得到BaCl2 • 2H2O
(6)10吨含78.8% BaCO3的钡矿粉理论上最多能生成BaCl2 • 2H2O___________吨。
重铬酸钠(Na2Cr2O7•2H2O)俗称红矾钠,在工业上有广泛的用途。我国目前主要是以铬铁矿(主要成份为FeO•Cr2O3,还含有Al2O3、MgO、SiO2等杂质)为主要原料进行生产,其主要工艺流程如下:
①中涉及的主要反应有:
主反应: 4FeO·Cr2O3+8Na2CO3+7O2  8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2
副反应:SiO2+Na2CO3  Na2SiO3+CO2↑、Al2O3+Na2CO3
Na2SiO3+CO2↑、Al2O3+Na2CO3  2NaAlO2+CO2↑
2NaAlO2+CO2↑
部分阳离子以氢氧化物形式完全沉淀时溶液的pH:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Mg(OH)2 |
Cr(OH)3 |
| 完全沉淀时溶液pH |
4.7 |
3.7 |
11.2 |
5.6 |
试回答下列问题:
(1)“①”中反应是在回转窑中进行,反应时需不断搅拌,其作用是 。
(2)“③”中调节pH至4.7,目的是 。
(3)“⑤”中加硫酸酸化的目的是使CrO42-转化为Cr2O72-,请写出该平衡转化的离子方程式: 。
(4)制取红矾钠后的废水中还含有少量的CrO42-,根据有关标准,含CrO42-的废水要经化学处理,使其浓度降至5.0×10-7 mol·L-1以下才能排放。含CrO42-的废水处理可用还原法:
CrO42- Cr3+
Cr3+  Cr(OH)3。绿矾还原CrO42-的离子方程式为: 。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol/L的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
Cr(OH)3。绿矾还原CrO42-的离子方程式为: 。用该方法处理10 m3CrO42-的物质的量浓度为1.5×10-3 mol/L的废水,至少需要绿矾(FeSO4•7H2O,相对分子质量为278)的质量是 Kg(保留两位小数)。
(14分)一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的离子反应方程式为(产物中只有一种酸根) 。请从反应原理分析不用盐酸酸化的主要原因____________________________________。
(3)碳酸钠溶液在过程III和IV中所起作用有所不同,请分别用离子方程式表示在过程III、IV中起的作用:__________________________________;____________________________。
(4)某天然碱的化学式可表示为2Na2CO3·NaHCO3·2H2O,取少量该物质溶于水得稀溶液P。下列有关溶液P中微粒的物质的量浓度关系正确的是______(填序号)。
| A.c(CO32-) > c(HCO3-)> c(OH-)> c(H+) |
| B.c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| C.3c(Na+)>5c(CO32-)+5c(HCO3-) |
| D.将P溶液与少量NaOH溶液混合:c(Na+)+ c(H+)=c(HCO3-)+2c(CO32-)+ c(OH-) |
(5)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是_______________。
(I)阅读下面信息,推断元素,按要求回答问题:
| 信息 |
问题 |
| ①短周期元素X、Y、Z、W,原子序数依次增大, 最外层电子数均不少于最内层电子数 |
⑴仅针对信息①,X一定不是 A.氢 B.碳C.氧 D.硫 |
| ②一定条件下,上述四种元素的单质均能与足量的氧气反应,生成的氧化物有两种能溶于稀硫酸,三种能溶于浓NaOH,氧化物的相对式量都大于26 |
⑵这四种元素含有铝元素吗? 。 |
| ③上述四中元素的单质的混合物,加入足量的盐 酸溶液,固体部分溶解,过滤,向滤液中加入过 量的烧碱溶液,最终溶液中有白色沉淀 |
⑶白色沉淀的化学式为 。 |
| ④在W的最价氧化对应的水化合的含氧酸钠盐溶液中,加过量的盐酸能生成白色沉淀。 |
⑷生成白色沉淀的离子方程式为 。 |
| ⑤X与W同主族 |
⑸X的最高价氧化物的电子式为 。 |
(II)已探明我国锰矿储量占世界第三位,但富矿仅占6.4%,每年尚需进口大量锰矿石。有人设计了把我国的贫菱锰矿(MnCO3含量较低)转化为高品位“菱锰矿砂”(MnCO3含量高)的绿色工艺。该工艺流程如下图所示:
已知焙烧反应①的化学方程式:(NH4)2SO4+MnCO3 MnSO4+2NH3↑+CO2↑+H2O。
MnSO4+2NH3↑+CO2↑+H2O。
(1)写出反应②的离子方程式_______________________________________。
(2)上述工艺流程中,可以循环利用的物质有(NH4)2SO4、____________、__________。从物料平衡角度看,理论上生产过程中_________(填“需要”或者“不需要”)添加(NH4)2SO4。
CrCl3是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性
条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如图。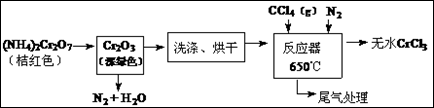
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因
如何用简单方法判断其已洗涤干净
(2)已知CCl4沸点为57.6℃,为保证稳定的CCl4气流,适宜的加热方式是
(3)用下图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400℃,开始向三颈烧瓶中通人氮气,使CCl4蒸气经氮气载人反应室进行反应,继续升温到650℃;③三颈烧瓶中装入150mLCCl4,并加热CCl4,温度控制在50~60℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通人氮气;⑥检查装置气密性。正确的顺序为: 
(4)已知反应管中发生的主要反应有:Cr2O3 + 3CCl4 → 2CrCl3 + 3COCl2,因光气剧毒,实验需在通风橱中进行,并用正丙醇处理COCl2,生成一种含氧酸酯(C7H14O3)。
用正丙醇处理尾气的化学方程式为
(5)样品中三氯化铬质量分数的测定
称取样品0.4000g,加水溶解并定容于250mL容量瓶中。移取25.00mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸后加入1gNa2O2,充分加热煮沸,适当稀释,然后加入过量的2mol/LH2SO4至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1gKI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用0.0250mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00mL。
已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI。
①该实验可选用的指示剂名称为
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是
③样品中无水三氯化铬的质量分数为
稀土元素是周期表中Ⅲ B族钪、钇和镧系元素的总称,它们都是很活泼的金属,性质极为相似,常见化合价为+3。其中钇(Y)元素是激光和超导的重要材料。
我国蕴藏着丰富的钇矿石( Y2 FeBe2Si2O10),以此矿石为原料生产氧化钇(Y2O3)的主要流程如下:
已知:
I.有关金属离子形成氢氧化物沉淀时的pH如下表:
| |
开始沉淀时的pH |
完全沉淀时的pH |
| Fe3+ |
2.7 |
3.7 |
| Y3+ |
6.0 |
8.2 |
Ⅱ.在周期表中,铍、铝元素处于第二周期和第三周期的对角线位置,化学性质相似。
(1)钇矿石(Y2 FeBe2Si2O10)的组成用氧化物的形式可表示为 。
(2)欲从Na2 SiO3和Na2BeO2的混合溶液中制得Be(OH)2沉淀。则
①最好选用盐酸、 (填字母代号)两种试剂,再通过必要的实验操作方可实现。
a.NaOH溶液 b.氨水 c.CO2气 d.HNO3
②写出Na2BeO2与足量盐酸发生反应的离子方程式: :必要的实验操作应是 。
(3)为使Fe3+沉淀完全,须用氨水调节pH =a,则a应控制在 的范围内;继续加氨
水调节pH =b发生反应的离子方程式为 ,溶液中Fe3+完全沉淀的判定标准是 。
(4)写出草酸钇[Y2(C2O4)3.Nh2O]煅烧的化学方程式 。
[化学--修2:化学与技术](15分)
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下: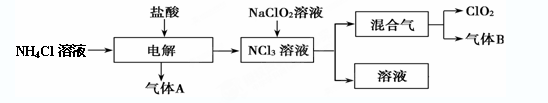
(1) ClO2中所有原子 (填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用
A.饱和食盐水 B.碱石灰 C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3) 欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为 。缺点主要是产率低、产品难以分离,还可能污染环境。
(4) 我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是 ,此法相比欧洲方法的优点是 。
(5) 科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_______________________。此法提高了生产及储存、运输的安全性,原因是_________。
碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下: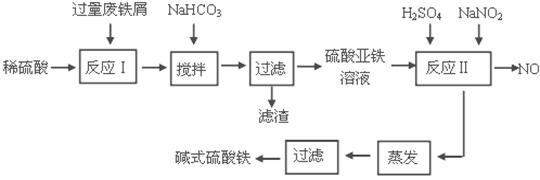
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是调节pH在 范围内。
(2)反应Ⅱ中加入NaNO2的目的是氧化亚铁离子,写出该反应的离子方程式为
。
(3)实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,若参与反应的O2体积为 11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后生成的Fe(OH)2+离子可部分水解生成Fe2(OH)42+ 聚合离子,该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)为测定含Fe2+和Fe3+溶液中铁元素的总含量,实验操作如下:准确量取20.00mL溶液于带塞锥形瓶中,加入足量H2O2,调节pH<3,加热除去过量H2O2;加入过量KI充分反应后,再用 0.1000 mol·L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:
则溶液中铁元素的总含量为 g·L-1。若滴定前溶液中H2O2没有除尽,所测定的铁元素的含量将会
(填“偏高” “偏低” “不变”)
废旧碱性锌锰干电池内部的黑色物质A主要含有MnO2、NH4CI、ZnCI2,还有少量的FeCI2和炭粉,用A制备高纯MnCO3,的流程图如下。
(1)碱性锌锰干电池的负极材料是_________(填化学式)。
(2)第Ⅱ步操作的目的是________________________。
(3)第Ⅳ步操作是对滤液a进行深度除杂,除去Zn2+的离子方程式为____________________。
(已知:Ksp(MnS)=2.5×10-13,Ksp(ZnS)=1.6×10-24)
(4)为选择试剂X,在相同条件下,分别用5 g黑色物质M进行制备MnSO3的实验,得到数据如右表: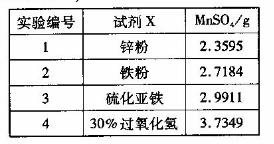
①试剂x的最佳选择是_________。
②第Ⅲ步中用选出的最佳试剂X与M的主要成分反应的化学方程式为_________。
(5)已知:MnCO3难溶于水和乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH为7.7。请补充完成以下操作:
第Ⅴ步系列操作可按一下流程进行:请补充完成操作:(第Ⅴ步系列操作中可供选用的试剂: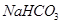 、乙醇)
、乙醇)
操作1:___________________;操作2:过滤,用少量水洗涤2~3次
操作3:检测滤液,表明SO42-已除干净; 操作4:___________________;
操作5:低温烘干。
(6)操作1可能发生反应的离子方程式
选修:化学与技术】(金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀等性质被广泛用在高新科技材料和航天领域中。“硫酸法”生产钛的原料是钛铁矿(主要成分是:FeTiO3,还含有少量Mn、Zn、Cr、Cu等重金属元素及脉石等杂质);主要生产流程如下:
已知反应:①将钛铁矿与浓H2SO4煮解:FeTiO3+2H2SO4(浓)△TiOSO4(硫酸氧钛)+FeSO4+2H2O。②加水热分解硫酸氧钛:TiOSO4+(n+1)H2O△TiO2·nH2O+H2SO4。
请回答下列问题:
(1)副产品甲是____________,可循环利用的物质是___________________________。
(2)上述生产流程中加入铁屑的目的是_______________________________________。
(3)写出中间产品乙与焦炭、氯气在高温下发生反应的方程式为:________________。
(4)“硫酸法”生产钛排放的废液对水体有哪些污染,请指出主要的两点:
①_________________________________;②_______________________________。
针对其中一项污染,提出处理的方法: 。
(2014届北京市东城区高三下学期零模诊断理综化学试卷)
重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下:

请回答:
(1)已知Fe(CrO2)2中铬元素是+3价,则Fe(CrO2)2中铁元素是____价。
(2)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成____。
(3)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:

为了加快该反应的反应速率,可采取的措施是____。
(4)已知CrO42—在不同的酸性溶液中有不同的反应,如:

①往混合溶液甲中加入硫酸必须适量的原因是____。
②混合溶液乙中溶质的化学式是____。
(5)+3、+6价铬都有很强的毒性,+6价铬的毒性更高,可诱发肺癌和鼻咽癌,所以制取红矾钠后的废水中含有的Cr2O72—必须除去。工业上可用电解法来处理含Cr2O72—的废水,下图为电解装置示意图(电极材料分别为铁和石墨)。通电后,Cr2O72—在b极附近转变为Cr3+,一段时间后Cr3+最终可在a极附近变成Cr(OH)3沉淀而被除去。

a电极的电极反应式是 ,
b电极附近反应的离子方程式是 。
(2014届山东省日照市高三3月模拟考试理综化学试卷)
亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。工业设计生产NaClO2的主要流程如下:

(1)A的化学式是 ,装置III中A在 极区产生。
(2)II中反应的离子方程式是 。
(3)通电电解前,检验III中阴离子的方法和步骤是 。
(4)为防止II中制备的NaClO2被还原成NaCl,应选合适的还原剂,除双氧水外,还可以选择的还原剂是 (填字母编号)。
a.Na2O2 b.FeCl2 c.Na2S
(5)常温时,HClO2的电离平衡常数Ka=1.07 10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中
10-2mol·L-1,II中反应所得NaClO2溶液(含少量NaOH)的pH=13,则溶液中 = 。
= 。
(6)气体a、b与氢氧化钠溶液可构成燃料电池,用该电池电解200 mL 0.5 mol·L-1的CuSO4溶液,生成铜3.2 g,此时所得溶液中离子浓度由大到小的顺序是
氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3 )为原料制备高纯氧化镁的实验流程如下:

(1)MgCO3与稀硫酸反应的离子方程式为 。
(2)加入H2O2氧化时,发生反应的化学方程式为 。
(3)滤渣2 的成分是 (填化学式)。
|
(4)煅烧过程存在以下反应:
|
2MgSO4+C="==" ="==" 2MgO+2SO2↑+CO2↑
|
MgSO4+C="==" ="==" MgO+SO2↑+CO↑
MgSO4+3C="==" ="==" MgO+S↑+3CO↑
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Fe(OH)3 |
Fe(OH)2 |
Ni(OH)2 |
| 开始沉淀的pH |
1.5 |
6.5 |
7.7 |
| 沉淀完全的pH |
3.7 |
9.7 |
9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下��验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价 (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为 。
试题篮
()