【化学一选修2:化学与技术】(15分)
利用硫酸工业废渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: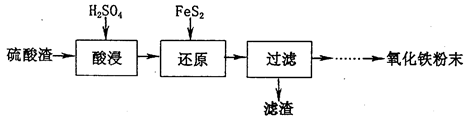
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②__________________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO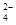 ,该反应的离子方程式为____________.
,该反应的离子方程式为____________.
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。
实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-===2Fe2++SnCl
Sn2++4Cl-+2HgCl2="==" SnCl +Hg2Cl2↓
+Hg2Cl2↓
6Fe2++ Cr2O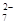 +14H+===6Fe3++2Cr3++7H2O
+14H+===6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量__________(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量偏高,其原因是_____________。
(4)①可选用______________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是_________________(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的,pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________;b.沉淀:_____________________________;
c.分离,洗涤;d.烘干,研磨。
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,用作杀菌剂、防腐剂、解酸剂、油类漂白剂及封闭胶泥的快干剂,在食品、牙粉、化妆品等制造中用作添加剂。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。
请回答下列问题:
(1)操作①中应包括 、 、 用氨水调节pH至8~9的目的是______________。
(2)若测得滤液C中c(CO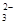 )=2.50×10-4 mol·L-1,则Ca2+_ _____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
)=2.50×10-4 mol·L-1,则Ca2+_ _____(填“是”或“否”)沉淀完全。[已知c(Ca2+)≤10-5 mol·L-1可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH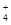 ) c(NO
) c(NO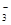 ) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为 。
) (填 > 、< 或 = ),(NH4)2CO3溶液中离子浓度由大到小的顺序为 。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式:_______________,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9~11,才出现大量沉淀。用简要的文字解释需用氢氧化钠调节pH至9~11的原因_________________________。
(5)写出CaO2与H2O反应的化学方程式 。
下图是某企业设计的硫酸—磷肥—水泥联产、海水—淡水多用、盐—热—电联产的三大生态产业链流程图。
根据上述产业流程回答下列问题:
(1)该流程①、②、③、④、⑤为能量或物质的输送,请分别写出输送的主要物质的化学式或能量形式:① 、② 、③ 、④ 、⑤ 。
(2)沸腾炉发生反应的化学方程式: 。磷肥厂的主要产品是普钙(磷酸二氢钙和硫酸钙),写出由磷矿石和硫酸反应制普钙得化学方程式 。
(3)用1吨硫铁矿(FeS2的质量分数为36%)接触法制硫酸,制硫酸的产率为65%,则最后能生产出质量分数为98%的硫酸 吨。
(4)热电厂的冷却水是 ,该流程中浓缩盐水除提取盐以外还可提取的物质有 (写出一种即可)。
(5)根据现代化工厂设计理念请提出高炉炼铁厂废气、废渣及多余热能的利用设想。
, (写出两点即可)。
工业上利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬等金属,回收流程如下: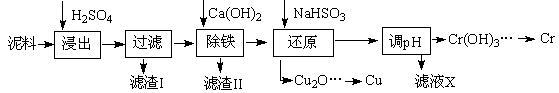
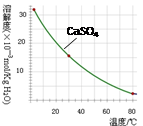
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
| |
Fe3+ |
Cu2+ |
Cr3+ |
| 开始沉淀pH |
2.1 |
4.7 |
4.3 |
| 完全沉淀pH |
3.2 |
6.7 |
a |
(1)在浸出过程中除了生成Fe2(SO4)3、Cr2(SO4)3外,主要还有
(2)在除铁操作中,需要除去Fe3+和CaSO4,请完成相关操作:①加入石灰乳调节pH到 ;②将浊液加热到80℃, 。
(3)写出还原步骤中加入NaHSO3生成Cu2O固体的离子反应方程式 ,此步骤中加入NaHSO3得到Cu2O的产率为95%,若NaHSO3过量,除了浪费试剂外,还会出现的问题是 。
(4)当离子浓度≤1×10—5 mol•L-1认为沉淀完全,若要使Cr3+完全沉淀则要保持C(OH—)≥ 。已知:Ksp[Cr(OH)3]=6.3×10-31,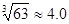 )
)
铬铁矿的主要成分的化学式为FeO·Cr2O3,还含有SiO2、Al2O3等杂质。工业上常采用固体碱熔氧化法用铬铁矿粉制备重铬酸钾,流程为:
已知:①NaFeO2遇水强烈水解;
②重铬酸钾为橙红色针状晶体,溶于水,不溶于乙醇,有强氧化性;
③2CrO42- + 2H+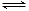 Cr2O72-+ H2O
Cr2O72-+ H2O
(1)灼烧操作一般在坩埚中进行,下列物质适合用来制作此实验坩埚材料的是
| A.铁 | B.氧化铝 | C.石英 | D.陶瓷 |
(2)①铬铁矿经粉碎处理的目的是 。
②写出Cr2O3和纯碱、氧气反应生成Na2CrO4的化学方程式为 ;
③NaFeO2水浸时强烈水解生成氢氧化铁沉淀,离子方程式为___ ___。
(3)滤液1的成分除Na2CrO4、NaOH外,还含有(填化学式) ,
(4)通过途径Ⅰ从Na2CrO4溶液获得K2Cr2O7晶体,操作步骤有:“酸化”→加KCl固体→蒸发浓缩→操作a→过滤→洗涤→干燥。
① “酸化”步骤用醋酸调节溶液pH<5,其目的是 ;
②操作a的名称 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+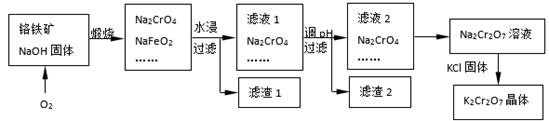
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 |
AgCl |
AgBr |
AgCN |
Ag2CrO4 |
AgSCN |
| 颜色 |
白 |
浅黄 |
白 |
砖红 |
白 |
| Ksp |
1.34×10-6 |
7.1×10-7 |
1.1×10-8 |
6.5×10-5 |
1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产Zn(NO3)2·6H2O晶体,其工艺流程为: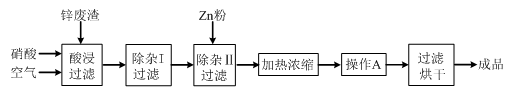
有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
4.2 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
6.7 |
8.0 |
⑴在“酸浸”步骤中,为提高锌的浸出速率,除通入空气“搅拌”外,还可采取的措施是 。
⑵上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
⑶在“除杂I”步骤中,需再加入适量H2O2溶液,H2O2与Fe2+反应的离子方程式为 。为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 。检验Fe3+是否沉淀完全的实验操作是 。
⑷加入Zn粉的作用是 。“操作A”的名称是 。
难溶性杂卤石(K2SO4·MgSO4·2CaSO4·2H2O)属于“呆矿”,在水中存在如下平衡:
K2SO4·MgSO4·2CaSO4·2H2O(s)  2Ca2++2K++Mg2++4
2Ca2++2K++Mg2++4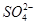 +2H2O
+2H2O
为能充分利用钾资源,用饱和Ca(OH)2溶液溶浸杂卤石制备硫酸钾,工艺流程如下:
(1)滤渣主要成分有________和________以及未溶杂卤石。
(2)用化学平衡移动原理解释Ca(OH)2溶液能溶解杂卤石浸出K+的原因:_________________________________________________。
(3)“除杂”环节中,先加入________溶液,经搅拌等操作后,过滤,再加入________溶液调滤液pH至中性。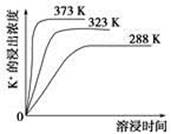
(4)不同温度下,K+的浸出浓度与溶浸时间的关系如图。由图可得,随着温度升高,
①________________________________________________________,
②________________________________________________________。
(5)有人以可溶性碳酸盐为溶浸剂,则溶浸过程中会发生:CaSO4(s)+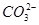
 CaCO3(s)+
CaCO3(s)+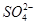
已知298 K时,Ksp(CaCO3)=2.80×10-9,
Ksp(CaSO4)=4.90×10-5,求此温度下该反应的平衡常数K(计算结果保留三位有效数字)。
分子筛具有吸附能力强,热稳定性高等优良性能,使得分子筛获得广泛应用,某种型号分子筛的工业生产流程可表示如下: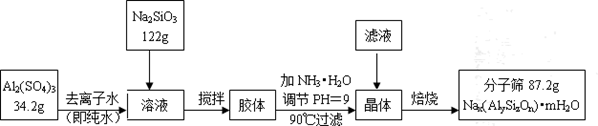
在滴加氨水调节pH=9的过程中,若pH控制不当,会有Al(OH)3生成,假设生产过程中铝元素、硅元素均没有损失,钠原子利用率为10%。
(1)分子筛的直径为4A(1A=10-10m)称为4A型分子筛,当Na+被Ca2+取代时就制得5A型分子筛,当Na+被K+取代时就制得6A型分子筛。要高效分离正丁烷(分子直径为4.65A)和异丁烷(分子直径为5.6A)应该选用_______型分子筛。
(2)Al2(SO4)3溶液与Na2SiO3溶液反应生成胶体的离子方程式为________________________
(3)该生产流程中所得滤液里含有的离子除H+、OH-外,主要还有 等离子。检验其中金属阳离子的操作方法是 ;
(4)加NH3•H2O调节pH后,加热到90℃并趁热过滤的原因可能是 。
(5)该生产流程中所得分子筛的化学式为 。(用氧化物形式表示)
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下: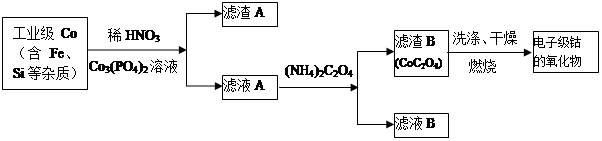
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为: 。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式: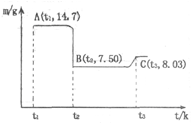
①AB段: ;
②BC段 。
(15分)2012年4月15日,央视曝光河北一药用胶囊厂用皮革废料所生产明胶作原料。这些企业用生石灰处理皮革废料进行脱色漂白和清洗,随后熬制成工业明胶,卖给浙江新昌县药用胶囊生产企业,最终流向药品企业,进入消费者腹中。记者调查发现9家药厂的13个批次药品所用胶囊重金属铬含量超标。重铬酸钠俗称红矾钠(Na2Cr2O7·2H2O)是重要的化工产品和强氧化剂。工业制备的流程如下: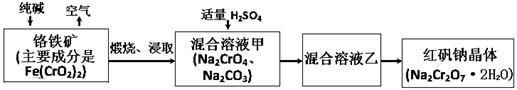
(1)化学上可将某些盐写成氧化物的形式,如Na2SiO3可写成Na2O·SiO2,则Fe(CrO2)2可写成 。
(2)煅烧铬铁矿时,矿石中难溶的Fe(CrO2)2生成可溶于水的Na2CrO4,反应化学方程式如下:4Fe(CrO2)2+8Na2CO3+7O2 = 2Fe2O3+8Na2CrO4+8CO2为了加快该反应的反应速率,可采取的措施是 。(写一种即可)
(3)已知CrO42-在不同的酸性溶液中有不同的反应,如:2CrO42-+2H+= Cr2O72-+H2O ;
3CrO42-+4H+= Cr3O102-+2H2O ① 往混合溶液甲中加入硫酸必须适量的原因是 。
② 混合溶液乙中溶质的化学式是 。
(4)在含Cr2O72-废水中存在着平衡:Cr2O72-+H2O  2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
2CrO42-+2H+,请写出该平衡的平衡常数表达式K= ,若继续加水稀释,平衡将 移动(填“正向”、“逆向”“不”)。
(5)请配平碱性溶液还原法中发生的离子反应:□Cr2O72-+□S2-+□H2O - □Cr(OH)3+□S2O32-+□OH-
高锰酸钾是中学常用的试剂。工业上用软锰矿制备高锰酸钾流程如下。
(1)写出实验室利用KMnO4分解制取O2的化学方程式
(2)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是
| A.84消毒液(NaClO溶液) |
| B.双氧水 |
| C.苯酚 |
| D.75%酒精 |
(3)在滴定实验中,常用 (填“酸式”或“碱式”)滴定管量取KMnO4溶液。
(4)写出反应①的化学方程式
(5)操作Ⅰ的名称是 ;操作Ⅱ根据KMnO4和K2CO3两物质在 (填
性质)上的差异,采用 (填操作步骤)、趁热过滤得到KMnO4粗晶体。
(6)上述流程中可以循环使用的物质有 、 (写化学式),鉴于此现用100吨软锰矿(含MnO287.0%),理论上可生产KMnO4晶体 吨(不考虑制备过程中原料的损失)。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入过量废铁屑的目的是 。
(2)加入少量NaHCO3的目的是调节pH,使溶液中的____(选填“Fe3+”、“Fe2+”或“Al3+”)沉淀。该工艺流程中“搅拌”的作用是 。
(3)反应Ⅱ的离子方程式为 。在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2与NaNO2在反应中均作 。若参与反应的O2有11.2 L(标准状况),则相当于节约NaNO2的物质的量为 。
(4)碱式硫酸铁溶于水后产生的Fe(OH)2+离子,可部分水解生成Fe2(OH)42+聚合离子。该水解反应的离子方程式为 。
(5)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO。为检验所得产品中是否含有Fe2+,应使用的试剂为 。
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
(6)将11.9 g Mg、Al、Fe组成的合金溶于足量的NaOH溶液中,合金质量减少了2.7 g。另取等质量的合金溶于过量稀硝酸中,生成了6.72 L(标准状况下)NO,向反应后的溶液中加入适量NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀质量为 。
A.22.1 g B.27.2 g C.30 g D.无法确定
硫酸铅广泛应用于制造蓄电池。利用锌冶炼过程中的铅浮渣生产硫酸铅的流程如下:
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9×10-5,Ksp(PbSO4)=1.6×10-8。
(1)已知步骤Ⅰ有NO产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的离子方程式 、 。
(2)步骤Ⅰ需控制硝酸的用量并使Pb稍有剩余,目的是 。
(3)母液可循环利用于步骤Ⅰ,其溶质主要是 (填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是 。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去 。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为 。
工业上常回收冶炼锌废渣中的锌(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质),并用来生产ZnSO4·6H2O晶体,其工艺流程如下,有关氢氧化物沉淀时的pH如下表。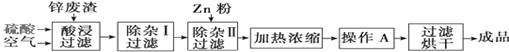
| 氢氧化物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Zn(OH)2 |
| 开始沉淀的pH |
3.3 |
1.5 |
6.5 |
5.4 |
| 沉淀完全的pH |
5.2 |
3.7 |
9.7 |
8.0 |
(1)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(2)在“除杂Ⅰ”步骤中,需再加入适量H2O2溶液的目的是 。
为使Fe(OH)3、Al(OH)3沉淀完全,而Zn(OH)2不沉淀,应控制溶液的pH范围为 。
为控制上述PH范围可选择加入的试剂或药品是 。
A.ZnO B.氨水 C.固体NaOH D.ZnCO3
(3)在“除杂Ⅱ”步骤中,加入Zn粉的作用是 。“操作A”的名称是 。
(4)常温下,已知Ksp〔Cu(OH)2〕=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于 。
试题篮
()