从银铜合金废料中回收银并制备铜化工产品的工艺如下:
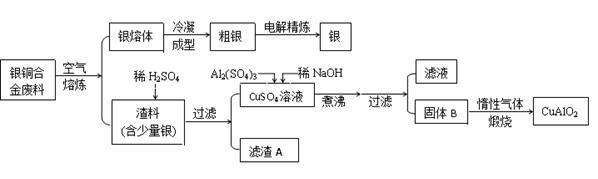
已知:①铝元素在溶液中的存在形态与溶液pH的关系如下图所示。

②室温时,Cu(OH)2的溶度积Ksp=2.0×10-20。(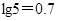 )
)
③Al(OH)3和Cu(OH)2开始分解的温度分别为450 ℃和80 ℃。
请回答下列问题:
(1)电解精炼银时,粗银做 极(填“阴”或“阳”),阴极电极反应为 。
(2)在生成固体B的过程中,需控制NaOH的加入量,使溶液的pH范围在 ,若控制不当,使NaOH过量可能会引起的反应的离子方程式为 。
(3)煅烧过程中发生多步反应,写出最终生成CuAlO2的反应的化学方程式: 。
(4)若银铜合金中铜的质量分数为64%,理论上1.0 kg废料中的铜可完全转化为CuAlO2,至少需要1.0 mol·L-1的Al2(SO4)3溶液 L。
工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,流程如下:

(1)浸取时,溶液中的Fe2+易被空气中的O2氧化,其离子方程式为_____________。能提高烧渣浸取速率的措施有________________(填字母)。
A.将烧渣粉碎 B.降低硫酸的浓度 C.适当升高温度
(2)还原时,试剂X的用量与溶液pH的变化如图所示,则试剂X可能是______________(填字母)。

A.Fe粉 B.SO2 C.NaI
还原结束时,溶液中的主要阴离子有_________________。
(3)滤渣Ⅱ主要成分的化学式为_______________;由分离出滤渣Ⅱ后的溶液得到产品,进行的操作是_____________、_____________过滤、洗涤、干燥。
Ni元素化合物在生活中有非常重要的应用。纳米NiO可以制备超级电容器,NiOOH是制作二次电池的重要材料。现以NiSO4为原料生产纳米NiO和NiOOH流程如下:

(1)制备NiOOH过程中,NiSO4溶液配制方法__________________;过滤、洗涤后,得到Ni(OH)2固体,如何证明Ni(OH)2已经完全洗净______________;NaClO氧化Ni(OH)2的离子方程式为_________________。
(2) 已知Ksp[Ni(OH)2] = 2×10-15。室温下,欲加入一定量 NaOH固体使1L 含有0.001 mol·L-1的NiSO4和0.0001 mol·L-1的H2SO4溶液中残留c(Ni2+)≤2×10-7 mol·L-1,并恢复至室温,所加入的NaOH的固体质量至少为________g。
(3)NH3·H2O的浓度对纳米NiO的产率产生很大影响。右图为NiSO4的物质的量一定时,不同的反应物配比对纳米氧化镍收率的影响。请解释反应物NH4HCO3 和NiSO4的物质的量比在2.5至4.0时,收率升高的原因__________________。
(4)制备纳米 NiO 时,加入一些可溶于水的有机物(如:吐温—80)能制得更优质的纳米材料,原因是__________________。
(5)沉降体积是超细粉体的一个重要参数,若颗粒在液相中分散性好,则沉降体积较小;若颗粒分散性较差,则易引起絮凝沉降体积较大。右图是吐温—80 的加入量与前体在液体石蜡中沉降体积的关系曲线。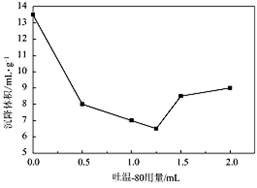
通过右图分析,吐温—80的最佳加入量为__________mL。
(6)NiOOH是制备镍镉电池的原料,某镍镉电池的总反应为
Cd+2NiOOH + 2H2O Cd(OH)2+ 2Ni(OH)2
Cd(OH)2+ 2Ni(OH)2
该电池放电时正极电极反应式为______________________________。
【选修2:化学与技术】锌是一种应用广泛的金属,目前工业上主要采用“湿法”工艺冶炼锌。某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: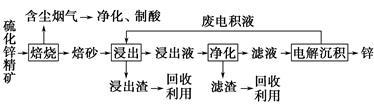
回答下列问题:
(1)硫化锌精矿的焙烧在氧气气氛的沸腾炉中进行,所产生焙砂的主要成分的化学式为___________。
(2)焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的____________________操作。
(3)浸出液“净化”过程中加入的主要物质为___________ ,其作用是__________________。
(4)电解沉积过程中的阴极采用铝板,阳极采用Pb-Ag合金惰性电极,阳极逸出的气体是________。
(5)改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质。“氧压酸浸”中发生的主要反应的离子方程式为___________。
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X__________________,Y________________。
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________;生产过程中调节溶液的pH不能过大的原因是________________。
(3)写出产生CuCl的化学方程式:______________________。
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_____________。
合成材料的应用与发展,大大方便了人类的生活,但由于合成材料废弃物的急剧增加带来了环境问题,废弃塑料带来的“白色污染”尤为严重。请你就怎样解决“白色污染”提出至少三条切实可行的措施。
(1)_________________________________;
(2)_________________________________;
(3)_________________________________;
(4)_________________________________。
硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量Fe2O3 、FeCO3 、MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是___________________。
(2)完成“氧化除铁”步骤中反应的离子方程式:
□Fe(OH)2+ □____+ □_____="=" □Fe(OH)3 + □Cl_
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H ,化学式式量为89,化学式是_______ 。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______ 。
| |
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
| 开始沉淀的pH |
10.4 |
6.4 |
— |
— |
| 沉淀完全的pH |
12.4 |
8.0 |
— |
— |
| 开始溶解的pH |
— |
10.5 |
— |
— |
| Ksp |
5.6×10-12 |
— |
6.8×10-6 |
2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是_________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为 ______ 、_______ 、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于 。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如图所示:
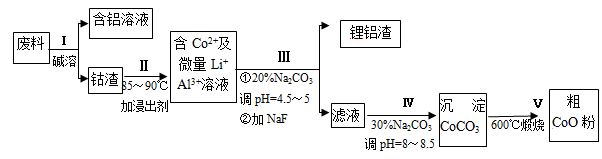
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程Ⅱ中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因 。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式 。
(4)碳酸钠溶液在过程Ⅲ和Ⅳ中所起作用有所不同,请写出在过程IV中起的作用是_____________。
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是____________(填序号)。
| A.c(Na+) = 2c(CO32-) | B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) | D.c(OH-)-c(H+) = c(HCO3-) + 2c(H2CO3) |
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,A物质的化学式是____________。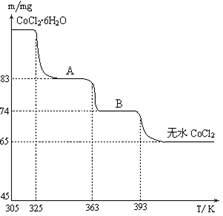
铁及其化合物有重要用途,如聚合硫酸铁[Fe2(0H)n(S04)3-n/2]m是一种新型高效的水处理混凝剂,而高铁酸钾(其中铁的化合价为+6)是一种重要的杀菌消毒剂,某课题小组设计如下方案制备上述两种产品:

请回答下列问题:
(1)若A为H20(g),可以得到Fe304,写出其转化的化学方程式: 。
(2)若C为KNO3和KOH的混合物,写出其与Fe2O3加热共融制得高铁酸钾的化学方程式 并配平:

(3)为测定溶液Ⅰ中铁元素的总含量,实验操作:准确量取20.00mL溶液Ⅰ于带塞锥形瓶中,加入足量H202,调节pH<3,加热除去过量H202;加入过量KI充分反应后,再用 O.1OOOmol.L-1Na2S2O3标准溶液滴定至终点,消耗标准溶液20.00mL。
已知:2Fe3++2I-=2Fe2++I2 I2+2S2O32-=2I-+S4O62-
①写出滴定选用的指示剂 ,滴定终点观察到的现象 。
②溶液Ⅰ中铁元素的总含量为 g.L-1。若滴定前溶液中H202没有除尽,所测定的铁元素的含量将会 (填“偏高”“偏低”“不变”)。
(4)将3.48gFe3O4完全溶解在100mL 1 mol·L-1H2SO4溶液中,然后加入K2Cr2O7溶液25mL,恰好使溶液中的Fe2+全部反应,Cr2O72-转化为Cr3+。则K2Cr2O7溶液的物质的量浓度为
工业上可用软锰矿(主要成分是MnO2)和黄铁矿(主要成分是FeS2)为主要原料制备高性能磁性材料碳酸锰(MnCO3)。其工业流程如下:


已知:MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解。
回答下列问题:
(1)净化工序的目的是除去溶液中的Cu2+、Ca2+等杂质。若测得滤液中c(F-)=0.01mol/L-1,滤液中残留的c(Ca2+)= 〔已知:Ksp(CaF2)=1.46×10-10〕
(2)沉锰工序中,298K、c(Mn2+)为1.05 mol/L-1时,实验测得MnCO3的产率与溶液pH、反应时间的关系如图所示。根据图中信息得出的结论是 。
(3)从沉锰工序中得到纯净MnCO3的操作方法是:过滤、 。
(4)为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到250mL容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol·L-1高锰酸钾溶液进行滴定,当滴入20.0mL溶液时恰好完全反应。
已知高锰酸钾、二氧化锰在酸性条件下均能将草酸钠(Na2C2O4)氧化:
2MnO4- + 5C2O42- + 16H+ ="=" 2Mn2+ + 10CO2↑+ 8H2O
MnO2 + C2O42- + 4H+ ="=" Mn2+ + 2CO2↑+ 2H2O
求该软锰矿中二氧化锰的质量分数 (写出计算过程)。
工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Al(OH)3 |
| 开始沉淀 |
2.3 |
7.5 |
3.4 |
| 完全沉淀 |
3.2 |
9.7 |
4.4 |
回答下列问题:
(1)加入少量NaHCO3的目的是 ,该工艺中“搅拌”的作用是 。
(2)反应Ⅱ中的离子方程式为 ,在实际生产中,反应Ⅱ常同时通入O2以减少NaNO2的用量,O2的作用是 。(用化学方程式表示)
(3)生产中碱式硫酸铁溶液蒸发时需要在常温减压条件下的原因是 。
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有Fe2+及NO3-。为检验所得产品中是否含有Fe2+,应使用的试剂为 。(填写字母)
A.氯水 B.KSCN溶液 C.NaOH溶液 D.酸性KMnO4溶液
利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)的处理工艺流程如下。
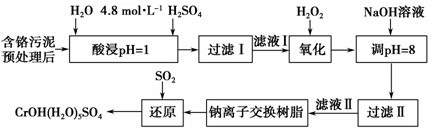
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)实验室用98%(密度是1.84g/cm3)的浓硫酸配制250 mL 4.8 mol·L-1的H2SO4溶液,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需___________,需要取用________ml98%(密度是1.84g/cm3)的浓硫酸.
(2)酸浸时,为了提高浸取率可采取的措施有____________________(答出两点)。
(3)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_________________。
(4)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
| 阳离子 |
Fe3+ |
Mg2+ |
Al3+ |
Cr3+ |
| 开始沉淀时的pH |
2.7 |
- |
- |
- |
| 沉淀完全时的pH |
3.7 |
11.1 |
8 |
9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_________________________。
(5)钠离子交换树脂的反应原理为Mn++nNaR―→MRn+nNa+,利用钠离子交换树脂除去的滤液Ⅱ中的金属阳离子是_______________________________。
(6)写出上述流程中用SO2进行还原时发生反应的化学方程式:_______________________。
(除标注外,每空2分,共8分)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。以含镍(Ni2+)废液为原料生产NiOOH的一种工艺流程如下:
(1)加入Na2CO3溶液时,确认Ni2+已经完全沉淀的实验方法是__ __。
(2)已知Ksp[Ni(OH)2]=2×10-15,欲使NiSO4溶液中残留c(Ni2+)≤2×10-5 mol·L-1,调节pH的范围是__ _。
(3)写出在空气中加热Ni(OH)2制取NiOOH的化学方程式:
____。
(4)若加热不充分,制得的NiOOH中会混有Ni(OH)2,其组成可表示为xNiOOH·yNi(OH)2。现称取9.18 g样品溶于稀硫酸,加入100 mL 1.0 mol·L-1 Fe2+标准溶液,搅拌至溶液清亮,定容至200 mL。取出20.00 mL,用0.010 mol·L-1 KMnO4标准溶液滴定,用去KMnO4标准溶液20.00 mL,试通过计算确定x、y的值。涉及反应如下(均未配平):
NiOOH+Fe2++H+——Ni2++Fe3++H2O
Fe2++MnO +H+——Fe3++Mn2++H2O
+H+——Fe3++Mn2++H2O
则x=____;y=__。
硫酸法是现代氧化铍或氢氧化铍生产中广泛应用的方法之一, 其原理是利用预焙烧破坏铍矿物(绿柱石—3BeO· Al2O3·6SiO2及少量FeO等)的结构与晶型, 再采用硫酸酸解含铍矿物, 使铍、铝、铁等酸溶性金属进入溶液相, 与硅等脉石矿物初步分离, 然后将含铍溶液进行净化、除杂, 最终得到合格的氧化铍( 或氢氧化铍) 产品, 其工艺流程如右图。
已知:(1)铝铵矾的化学式是NH4Al(SO4)2·12H2O
(2)铍元素的化学性质与铝元素相似
根据以上信息回答下列问题:
(1)熔炼物酸浸前通常要进行粉碎,其目的是:
(2)“蒸发结晶离心除铝”若在中学实验室中进行,完整的操作过程是______________洗涤、过滤。
(3)“中和除铁”过程中“中和”所发生反应的离子方程式是__________________,用平衡原理解释“除铁”的过程___________________________。
(4)加入的“熔剂”除了流程中的方解石外,还可以是纯碱、石灰等。其中, 石灰具有价格与环保优势, 焙烧时配料比( m石灰/ m绿柱石) 通常控制为1:3, 焙烧温度一般为1400℃—1500℃ 。若用纯碱作熔剂,SiO2与之反应的化学方程式是__________________________,若纯碱加入过多则Al2O2、BeO2也会发生反应,其中BeO与之反应的化学方程式是_______________________,从而会导致酸浸时消耗更多硫酸,使生产成本升高,结合离子方程式回答成本升高的原因___________________________。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0[ |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式_______________ _。
(2)写出NaClO3发生反应的主要离子方程式________________ ___;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式_______ __。
(3)“加Na2CO3调pH至a ( a="6" )”,过滤所得到的沉淀成分为 。
(4)“操作1”中包含3个基本实验操作,它们依次是______ ___、_______ ___和过滤。制得的CoCl2·6H2O在烘干时需减压烘干的原因是____________ __。
(5)萃取剂对金属离子的萃取率与pH的关系如图。向“滤液”中加入萃取 剂的目的是___ ___;其使用的最佳pH范围是___________。
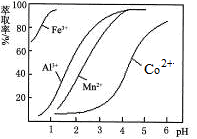
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
试题篮
()