(10分)碳酸铈[Ce2(CO3)3]为白色粉末,难溶于水,主要用作生产铈的中间化合物。它可由氟碳酸铈精矿经如下流程。
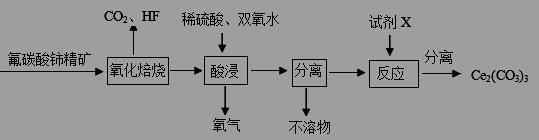
(1)氟碳酸铈的化学式为为CeFCO3,该化合物中,Ce的化合价为 。
(2)氧化焙烧生成的铈化合物为二氧化铈(CeO2),其在酸浸时发生反应的离子方程式为 。
(3)试剂X是 。
(4)若试剂X改为氢氧化钠溶液,则反应生成难溶物—一氢氧化铈(Ⅲ),其暴露于空气中时变成紫色,最终变成黄色的氢氧化高铈(Ⅳ)。氢氧化铈在空气中被氧化成氢氧化高铈的化学方程式为 。
(5)取(4)中得到的Ce(OH)4产品(质量分数为97%)1.00 g,加硫酸溶解后,用0.1000mol·L-1的FeSO4溶液滴定至终点(铈被还原成Ce3+),则需要滴加标准溶液的体积为 mL。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2·6H2O的流程如下:
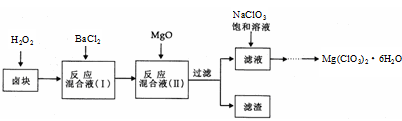
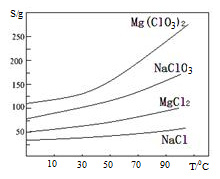
已知:①卤块主要成分为MgCl2·6H2O,含有MgSO4、FeCl2等杂质②四种化合物的溶解度(S)随温度(T)
变化曲线如图所示。
回答下列问题:
(1)过滤时主要的玻璃仪器有
(2)加入BaCl2的目的是除去杂质离子,检验已沉淀完全的方法是
(3)加速卤块在H2O2溶液中溶解的措施有: (写出一条即可)
(4)加入MgO的作用是 ;滤渣的主要成分为
(5)向滤液中加入NaClO3饱和溶液后,发生反应的化学方程式为:MgCl2+2NaClO3= Mg(ClO3)2↓+2NaCl,再进一步制取Mg(ClO3)2·6H2O的实验步骤依次为① ;②趁热过滤;③ ;④过滤、洗涤、干燥。
(6)产品中Mg(ClO3)2·6H2O含量的测定:
步骤1:准确称量3.50 g产品配成100 mL溶液。
步骤2: 取10.00 mL于锥形瓶中,加入10.00 mL稀硫酸和20.00mL 1.000 mol·L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.l000 mol·L-1K2Cr2O7溶液滴定剩余的Fe2+至终点,此过程中反应的离子方程式为:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O。
步骤4:将步骤2、3重复两次,计算得平均消耗K2Cr2O7溶液15.00 mL。
①写出步骤2中发生反应的离子方程式(还原产物为Cl-)
②产品中Mg(ClO3)2·6H2O的质量分数为(保留一位小数)
钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。
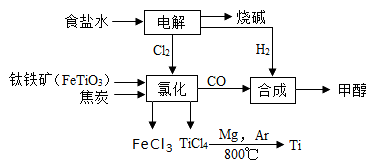
请回答下列问题:
(1)Fe位于元素周期表中第________________周期,第_______________族。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式 。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:
(4)反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于 ℃即可。
| |
TiCl4 |
Mg |
MgCl2 |
Ti |
| 熔点/℃ |
-25.0 |
648.8 |
714 |
1667 |
| 沸点/℃ |
136.4 |
1090 |
1412 |
3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 mol。
草酸钴用途广泛,可用于指示剂和催化剂的制备。一种利用水钴矿[主要成分为Co2O3,含少量Fe2O3、Al2O3、MnO、MgO、CaO等]制取CoC2O4·2H2O工艺流程如下:
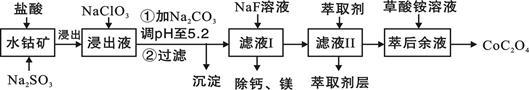
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 完全沉淀的pH |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
(1)浸出过程中加入Na2SO3的目的是将_____________还原(填离子符号)。
(2)NaClO3的作用是将浸出液中的Fe2+氧化成Fe3+,产物中氯元素处于最低化合价。该反应的离子方程式为____________。
(3)萃取剂对金属离子的萃取率与pH的关系如图所示。滤液Ⅱ中加入萃取剂的作用是_________;使用萃取剂适宜的pH是______。
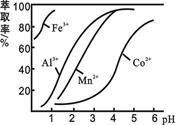
A.接近2.0 B.接近3.0 C.接近5.0
(4)“除钙、镁”是将溶液中Ca2+与Mg2+转化为MgF2、CaF2沉淀。已知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10。当加入过量NaF后,所得滤液c(Mg2+)/ c (Ca2+)= 。
七水硫酸镁(MgSO4•7H2O)在印染、造纸和医药等工业上都有广泛的应用,利用化工厂生产硼砂的废渣﹣硼镁泥可制取七水硫酸镁。硼镁泥的主要成分是MgCO3,还含有其他杂质(MgO、SiO2、Fe2O3、FeO、CaO、Al2O3、MnO等).
表1 部分阳离子以氢氧化物形式完全沉淀时溶液的pH
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Mg(OH)2 |
| pH值 |
5.2 |
3.2 |
9.7 |
10.4 |
11.2 |
表2 两种盐的溶解度(单位为g/100g水)
| 温度/℃ |
10 |
30 |
40 |
50 |
60 |
| CaSO4 |
0.19 |
0.21 |
0.21 |
0.20 |
0.19 |
| MgSO4•7H2O |
30.9 |
35.5 |
40.8 |
45.6 |
/ |
硼镁泥制取七水硫酸镁的工艺流程如下:

根据以上流程图并参考表格pH数据和溶解度数据,试回答下列问题:
(1)过滤I的滤液中加入硼镁泥,调节溶液的pH=5~6,再加入NaClO溶液加热煮沸,将溶液中的Mn2+氧化成MnO2,反应的离子反应方程式为 .加热煮沸的主要目的是 .
(2)沉淀B中除MnO2、SiO2外还含有 (填化学式)等物质.
(3)检验过滤Ⅱ后的滤液中是否含有Fe3+的实验方法是 ;
(4)沉淀C的化学式是 .过滤Ⅲ需趁热过滤的理由是 .
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:
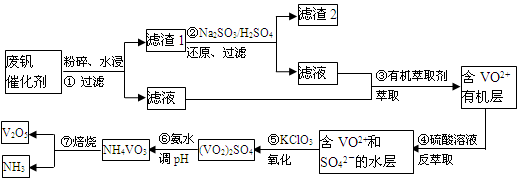
已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。
(2) VO2++H2C2O4+H+ → VO2+ + CO2↑+ H2O
回答下列问题:
(1)步骤②的目的是 。
(2)步骤③的变化过程可简化为(HA表示有机萃取剂):
VOSO4 (水层)+ 2HA(有机层) VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
VOA2(有机层)+ H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是 。
(3)若ClO3-将被还原为Cl-,请写出骤⑤中发生反应的离子方程式为 。
(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.00mL,由此可知(VO2)2SO4溶液钒元素的含量为 g/L。
(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为 。
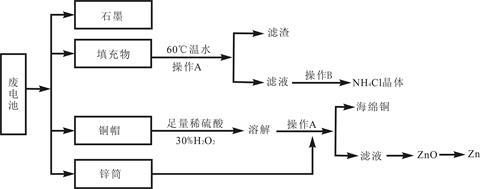
[化学—选修(二)化学与技术]常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
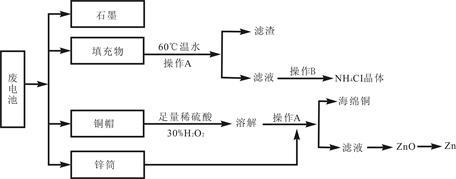
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为 2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:

根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。
【化学——选修2:化学与技术】
常见锌锰干电池因含有汞、酸或碱等,废弃后进入环境将造成严重危害。某化学兴趣小组拟采用如下处理方法回收废电池中的各种资源。
(1)填充物用60℃温水溶解,目的是 。
(2)操作A的名称为 。
(3)铜帽溶解时加入H2O2的目的是 (用化学方程式表示)。铜帽溶解完全后,可采用_________方法除去溶液中过量的H2O2。
(4)碱性锌锰干电池电解质为KOH,总反应Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2,其负极的电极反应式为 。
(5)滤渣的主要成分为含锰混合物,向含锰混合物中加入一定量的稀硫酸、稀草酸,并不断搅拌至无气泡为止。主要反应为2MnO(OH)+MnO2+2H2C2O4+3H2SO4=3MnSO4+4CO2↑+6H2O。
①当1 mol MnO2参加反应时,共有 mol电子发生转移。
②MnO(OH)与浓盐酸在加热条件下也可发生反应,试写出该应的化学方程式: 。
(6)锌锰干电池所含的汞可用KMnO4溶液吸收。在不同pH下,KMnO4溶液对Hg的吸收率及主要产物如下图所示:
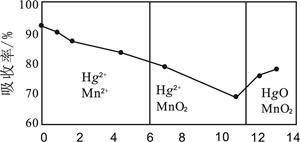
根据上图可知:
①pH对Hg吸收率的影响规律是随pH升高,汞的吸收率 。
②在强酸性环境下Hg的吸收率高的原因可能是KMnO4在酸性条件下 强。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的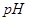 见下表:(金属离子浓度为:0.01mol/L)
见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至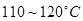 时,失去结晶生成无水氯化钴。
时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为 ,加入萃取剂的目的是 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
选考[化学—选修化学与技术]
通常情况下,当空气中CO2的体积分数超过0.050%时,会引起明显的温室效应。为减小和消除CO2对环境的影响,各国都在限制CO2的排量,同时也加强对CO2创新利用的研究。
(1)目前,推广用超临界CO2(介于气态和液态之间)代替氟利昂作致冷剂,这一做法对环境的积极意义是 。
(2)科学家为提取空气中的CO2,把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应使之变为可再生燃料甲醇。流程如图: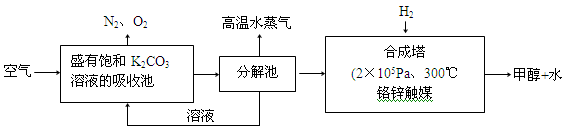
①分解池中反应的化学方程式为: 。
②合成塔中,若有4.4g CO2与足量H2恰好反应生成气态产物,放出4.947kJ的热量,写出该反应的热化学方程式: 。
(3)某同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积Ksp分别为4.96×10-9、2.58×10-9。他最好将空气通入足量的 溶液,实验时除测定温度、压强和空气的体积外,还需测定 。
【化学-选修2:化学与技术】镁合金废料回收最常用的是熔炼法,其主要工艺流程为:
废料预处理→熔化→除铁→除气和除渣→铸造。
(1)废料预处理包括粉碎、除油污和油漆。
①粉碎方法有干态机械粉碎法和湿喷机械粉碎法,其中容易造成危险的方法是 ,理由是 。
②把油污和油漆一次性除去最适宜的方法是
A.用热碱洗涤,过滤
B.用有机溶剂溶解,过滤
C.加热气化除去
(2)镁合金在加热到935K时熔化,并不断向其中通入氩气做保护气。若液态镁与空气接触,不但会发生反应产生杂质,而且降低了镁的回收率。写出与空气的两个主要反应方程式 、 。
(3)向熔融镁中加入固体硼砂(B2O3)除铁,生成FeB2沉渣,写出有关的化学反应方程式 。
(4)镁合金除了含有铁之外,还含有少量铝。加入C2Cl6可以除去液态镁中的氢气,还能把铝转化为Al4C3沉渣:
C2Cl6→2C+3Cl2 (1)
3C+4Al→Al4C3 (2)
①除气除渣炉排出的污染性气体有 。
②如果1t镁合金中,铝占3.6‰,则除去铝最少需要加入C2Cl6 g。
利用LiOH和钴氧化物可制备锂离子电池正极材料.LiOH可由电解法制备,钴氧化物可通过处理钴渣获得.
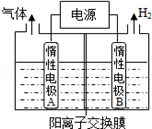
(1)利用如图装置电解制备LiOH,两电极区电解液分别为LiOH和LiCl溶液.B极区电解液为 溶液(填化学式),阳极电极反应式为 ,电解过程中Li+向 电极迁移(填“A”或“B”).
(2)利用钴渣[含Co(OH)3、Fe(OH)3等]制备钴氧化物的工艺流程如下:

Co(OH)3溶解还原反应的离子方程式为 ,铁渣中铁元素的化合价为 ,在空气中煅烧CoC2O4生成钴氧化物和CO2,测得充分煅烧后固体质量为2.41g,CO2的体积为1.344L(标准状况),则钴氧化物的化学式为 。
CoCl2·6H2O是一种饲料营养强化剂。一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2·6H2O的工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 |
Fe(OH)3 |
Fe(OH)2 |
Co(OH)2 |
Al(OH)3 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
7.6 |
7.6 |
4.0 |
7.7 |
| 完全沉淀 |
3.7 |
9.6 |
9.2 |
5.2 |
9.8 |
③CoCl2·6H2O熔点为86℃,加热至110~120℃时,失去结晶生成无水氯化钴。
(1)写出浸出过程中Co2O3发生反应的离子方程式 。
(2)写出NaClO3发生反应的主要离子方程式 ;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式 。
(3)“加Na2CO3调pH至5.2”,过滤所得到的沉淀成分为 ,加入萃取剂的目的是 。
(4)制得的CoCl2·6H2O在烘干时需减压烘干的原因是 。
(5)为测定粗产品中CoCl2·6H2O含量,称取一定质量的粗产品溶于水,加入足量HNO3酸化的AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量。通过计算发现粗产品中CoCl2·6H2O的质量分数大于100%,其原因可能是 。(答一条即可)
硼、镁及其化合物在工农业生产中应用广泛。
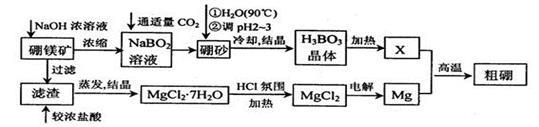
已知:硼镁矿主要成分为Mg2B2O5•H2O,硼砂的化学式为Na2B4O7•10H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂溶于热水后,常用H2SO4调pH2~3制取H3BO3,反应的离子方程式为 。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为 。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是 。若用惰性电极电解MgCl2溶液,其阴极反应式为 。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+==Mg2++2H2O,则正极反应式为 。若起始电解质溶液pH=1,则pH=2时溶液中Mg2+离子浓度为 。已知Ksp[Mg(OH)2]=5.6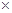 10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
10-12,当溶液pH=6时 (填“有”或“没有”)Mg(OH)2沉淀析出。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将 0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3(H2S2O3为弱酸)溶液滴定至终点,消耗Na2S2O3溶液18.00mL。盛装Na2S2O3溶液的仪器应为 滴定管(填“酸式”或“碱式”)。该粗硼样品的纯度为 。(提示:I2+2S2O32-=2I-+S4O62-)
辉铜矿是一种重要的铜矿石,主要含有硫化亚铜(Cu2S),还有Fe2O3、SiO2及一些不溶性杂质。一种以辉铜矿石为原料制备硝酸铜晶体的工艺流程如下:
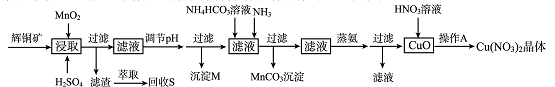
已知:部分金属阳离子生成氢氧化物沉淀的pH范围如下表所示(开始沉淀的pH按金属离子浓度为1.0 mol.L-1计算)。
| 离子 |
开始沉淀的pH |
沉淀完全的pH |
| Fe3+ |
1.1 |
3.2 |
| Mn2+ |
8.3 |
9.8 |
| Cu2+ |
4.4 |
6.4 |
回答下列问题:
(1)浸取后得到的浸出液中含有CuSO4、MnSO4。写出浸取时产生CuSO4、MnSO4反应的化学方程式 。
(2)调节pH的目的是 ,pH的调节范围为_____________。
(3)生成MnCO3沉淀的离子方程式为 。
(4)操作A为 。
(5)由辉铜矿制取铜的反应过程可以表示为:
2Cu2S(s)+3O2 (g) =2Cu2O(s)+2SO2(g) △H="-" 768.2 kJ.mol-l
2Cu2O(s)+Cu2S(s)=6Cu(s)+SO2 (g) △H="+116.0" kJ.mol-l
则由Cu2S与O2加热反应生成Cu的热化学方程式为_____________。
(6)若用含85% Cu2S的辉铜矿来制备无水Cu(NO3)2。假设浸取率为95%,调节pH时损失Cu 3%,蒸氨过程中有5%未转化为CuO,其它过程中无损耗,则1.0 kg这样的辉铜矿最多能制备 kg无水Cu(NO3)2。
试题篮
()