现有原子序数依次增大的W、T、X、Y、Z、R六种前四周期元素.TW3能使湿润的红色石蕊试纸变蓝色.X、Y位于同一主族且Y的原子序数是X的2倍.Z、R是生活中常见金属,Z、R的器皿在潮湿空气中分别生成红褐色锈和绿色锈.
请回答下列问题:
(1)TW3的电子式为 .
(2)由W、T、X、Y中的元索组成一种离子化合物M,能发生如图转化关系:
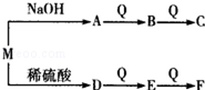
F与E的相对分子质量之差为16.则M的化学式可能为 .
C与水反应的化学方程式为 .
(3)(TW4)2Y2X8能和ZYX4在水溶液中反应生成Z2+和YX42﹣,写出离子方程式 .
(4)常温下,在WTX3浓溶液中以Z、R为电板构成原电池,负极材料是 ,
正极反应式为 .
A、B、C、D、E五种短周期元素,其原子序数逐渐增大。元素A的单质是密度最小的气体,元素B的单质存在两种以上同素异形体,且其中一种是自然界中硬度最大的单质,元素D的最外层电子数是次外层电子数的三倍。B、C、D、E四种元素均能与A形成电子数相等的四种分子,且化合物中各原子的个数比如下表:
| 化合物 |
甲 |
乙 |
丙 |
丁 |
| 原子个数比 |
B∶A=1∶3 |
C∶A=1∶2 |
D∶A=1∶1 |
E∶A=1∶1 |
下列说法正确的是( )
A.元素E在元素周期表中的位置为第二周期第ⅦA族
B.原子半径:A<B<C<D
C.A、C、E中三种元素或任意两种元素形成的物质中只可能含有共价键
D.A、B、C、D四元素中的三种能形成多种与甲分子电子数相等的化合物
X、Y、Z、W、R属于短周期元素.已知它们都不是稀有气体元素,X的原子半径最大,Y元素 的原子最外层电子数为m,次外层电子数为n,Z元素的原子L层电子数为m+n,M层电子数m﹣n,W元素与Z元素同主族,R元素原子与Y元素原子的核外电子数之比为2:1. 下列叙述错误的是
| A.X与Y形成的两种化合物中阴、阳离子的个数比均为1:2 |
| B.Y分别与Z、W、R以两种元素组成的常见化合物有5种 |
| C.Z、W、R最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z |
| D.Y的氢化物比R的氢化物稳定,Y的氢化物熔沸点比R的氢化物低 |
在一定条件下MO3与M-发生反应:MO3-+5M-+6H+=3M2+3H2O,则下列关于M元素的叙述中正确的是
| A.M位于元素周期表的第VA族 | B.M的氢化物的水溶液呈酸性 |
| C.MO3-中的M元素只能被还原 | D.M2在常温常压下一定是气体 |
现有部分短周期元素对应单质的性质或原子结构如下表所示:
| 元素编号 |
元素性质或原子结构 |
| X |
第三周期元素的简单离子中半径最小 |
| Y |
其最简单氢化物丙的水溶液呈碱性 |
| Z |
原子核外电子数和周期序数相等 |
A、B、C三种单质(分别有X、Y、Z元素组成)和甲、乙、丙、丁、戊五种化合物之间的转化关系如下图所示(某些条件已略去)。其中丁是一种高能燃料,一个分子含有18个电子,其组成元素与丙相同。

请回答:
(1)元素X在周期表中的位置是_______________,其简单离子的结构示意图为___________。
(2)单质B的电子式__________________。
(3)丙中所含的化学键类型有_________________________(填字母序号)。
a.离子键 b.极性共价键 c.非极性共价键
(4)反应②中,0.5molNaClO参加反应时,转移1mol电子,其化学方程式为:______________。
(5)一定条件下,A与TiO2、C(石墨)反应只生成乙和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。该化学方程式为______________________。
短周期主族元素X、Y、Z、M、N,且原子序数依次增大,已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3:4且M原子的质子数是Y原子的2倍,N-、Z+、X+的半径逐渐减小,化合物XN在常温下为气体,据此回答下列问题
(1)写出Z与N形成化合物的电子式____ _。
(2)X与Y可分别形成10电子和18电子的分子,写出该18电子分子转化成10电子分子的化学方程式__ __(分解反应)。
(3)下图表示由上述元素组成的两种气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:___ _ _。

(4)A、B均为由上述五种元素中的三种元素组成的强电解质,且组成元素的原子个数之比为1:1:1。若在各自的水溶液中,A能抑制水的电离,B能促进水的电离,则A的化学式为____,B的化学式为_______。A、B之间反应的离子方程式为 。A中存在的化学键类型为: 。
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;
由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。A、B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
已知A、B、C、D四种元素分别为短周期元素,表示中三个不同短周期的主族元素,且原子序数依次增
大。D原子的质子数是B原子质子数的2倍,A原子与D原子的最外层电子数之和是B原子与C原子质子
数之和的1/3。A与B可形成BA3型化合物,该化合物与C的单质在一定条件下反应,能生成化合物BC,请按要求填写下列空白:
(1)D元素的名称 ,C元素在元素周期表中的位置 。
(2)写出BA3的电子式 ,BA3跟C的单质在一定条件下反应,能生成化合物BC的化学方程式 。
(3)D单质在工业上最重要的用途是 ,写出工业上制取D单质的化学方程式 。
(4)在实验室中B的最高价氧化物的水化物的浓溶液应如何保存 ,用化学方程
式说明理由 。
a、b、c、d都是短周期元素,原子半径d>c>a>b,其中a、b处在同一周期,a、c处在同一主族。c原子核内质子数等于a和b的原子核内质子数之和,c原子最外层上的电子数是d原子最外层电子数的4倍。下列说法不正确的是( )
| A.a、c两元素位于元素周期表的ⅣA族 |
| B.d单质在b单质中燃烧生成的化合物中阴阳粒子个数比为1:1 |
| C.单质c可以和d的最高价氧化物的水化物发生反应 |
| D.工业上可用单质a冶炼单质c |
(I)A、B、C、D、E为短周期元素,非金属元素A最外层电子数与其周期数相同,B的最外层电子数是其所在周期数的2倍。B 在C中充分燃烧能生成其最高价化合物BC2。D+与C2-具有相同的电子数。A在E中燃烧,产物溶于水得到一种强酸。回答下列问题:(1)B在元素周期表中的位置是 ,写出一种工业制备单质E方法的离子方程式 。(2)这五种元素两两之间能形成多种化合物,请写出A2C和DA相互反应的化学方程式
(II)化合物甲由四种元素组成,撞击甲容易发生爆炸生成三种物质,产物之一是纯净固体单质乙,另两种产物丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一,3.0g甲发生爆炸反应,生成2.16g乙和标准状况下0.224L丁,其余为丙.回答下列问题:
(1)丁的结构式
(2)甲发生爆炸反应的化学方程式为
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,
爆炸反应中氧化产物与还原产物的物质的量之比为 .
已知X、M都是中学常见元素,下列对两个离子反应通式的推断中,其中正确的是
(甲)XO3n-+Xn-+H+→X单质+H2O(未配平);(乙)Mm++mOH-=M(OH)m↓
①若n=1,则XO3n-中X元素为+5价,X位于周期表第ⅤA族
②若n=2,则X最高价氧化物的水化物可能与它的氢化物反应
③若m=1,则M(NO3)m溶液和氨水互滴时的现象可能不同
④若m=2,则在空气中蒸干、灼烧MSO4溶液一定能得到MSO4
⑤若m=3,则MCl3与足量氢氧化钠溶液反应一定生成M(OH)m
| A.②③ | B.①③ | C.④⑤ | D.②④ |
A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质。已知:甲 + 乙 =丁 +辛,甲 + 丙 = 戊 + 辛;常温下0.1 mol/L 丁溶液的pH为13,则下列说法正确的是
A.元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键
B.元素B、C、D的原子半径由大到小的顺序为:r(D) > r(C) > r(B)
C.1.0 L 0. 1 mol/L戊溶液中含阴离子总的物质的量小于0. 1 mol
D.1 mol甲与足量的乙完全反应共转移约1.204 × 1024个电子
Ⅰ.请回答:
(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝。写出该反应的离子反应方程式: 。
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式: 。
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3)。现取适量这种钴的氧化物,可与480 mL 5 mol·L-1盐酸恰好完全反应,得到CoCl2溶液和6.72 L黄绿色气体(标准状况)。则该反应的化学反应方程式为 。
Ⅱ.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素。根据以下信息填空:
| 元素 |
相关信息 |
| A |
在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B |
工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C |
植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D |
室温下其单质为淡黄色粉末状固体,加热易熔化。该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E |
它在地壳中储量丰富,是人体不可缺少的微量元素之一。其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(4) C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1∶2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式: 。
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为 ;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是 。化合物Z仅由元素D和E组成, Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式: 。
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成 。
X、Y、Z、M、R、W均为周期表中前四周期的元素。X的基态原子外围电子排布式为3s2;Y原子的L电子层的P能级上有一个空轨道;Z元素的基态原子最外层有3个未成对电子,次外层有2个电子;M 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;R是海水中除氢、氧元素外含量最多的元素;W为过渡元素,它的基态原子外围电子排布成对电子数和未成对电子数相同且为最外层电子数的两倍。回答下列问题(相关回答均用元素符号表示):
(1)X的基态原子的外围电子排布式为 ,其基态原子有 种运动状态不同的电子;
(2)R的氢化物的稳定性比其上一周期同族元素氢化物的稳定性 (高或低)其原因是 ;
(3)ZM3﹣空间构型为 ,其中Z的杂化方式为 ;
(4)W与YM易形成配合物W(YM)5,在W(YM)5中W的化合价为 ;与YM分子互为等电子体的离子的化学式为 .
(5)W单质的晶体在不同温度下有两种原子堆积方式,晶胞分别如下图A、B所示:

图B中原子堆积方式为 ,A、B中W原子的配位数之比为 .A、B晶胞的棱长分别为a cm和b cm,则A、B两种晶体的密度之比为 。
(6)X和W组成的合金是目前已发现的储氢密度最高的储氢材料之一,其晶胞结构如图甲(黑球代表W,白球代表X).则该合金的化学式为 。
甲是一种可用于净水和膨化食品的盐,由A、B、C、D、E五种短周期元素组成。甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子。A元素原子核内质子数比E的少l,D、E同主族。某同学为探究甲的组成而进行如下实验:

①取mg甲的晶体溶于蒸馏水,配成500 mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20 mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224 mL。
回答下列问题:
(1)D在元素周期表中的位置为_ 。
(2)经测定晶体甲的摩尔质量为453 g·mol-1,其中阳离子和阴离子物质的量之比为1:1。则晶体甲的化学式为_ _。
(3)图像中V(Oa):V(ab):V(bc)= _ 。
(4)写出ab段发生反应的离子方程式:_ 。
(5)配成的甲溶液物质的量浓度是_ 。
试题篮
()