(12分)
Ⅰ.短周期元素组成的单质X2、Y,标准状况下X2的密度为3.17g·L-1;常温下,Y为浅黄色固体。Z是一种化合物,焰色反应呈浅紫色(透过钴玻璃);0.1mol·L-1 Z的水溶液pH=13。X2、Y 和Z之间有如下转化关系(其他无关物质已略去)
 (1)写出常温下单质X2与Z反应的离子方程式
(1)写出常温下单质X2与Z反应的离子方程式
(2)已知C能与硫酸反应生成能使品红溶液褪色的气体
①D的化学式是 ;D的水溶液pH>7,原因是(用离子方程式表示)
②将20mL 0.5mol·L-1 C溶液逐滴加入到20 mL 0.2mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。写出反应的离子方程式
Ⅱ.下表是元素周期表的一部分,表中所列的字母分别代表某一元素.
某种金属元素的单质G,可以发生如下图所示转化:
其中化合物M是一种白色胶状沉淀;K的溶液与过量B的某种氧化物反应的化学方程式为___________________________;一种新型无机非金属材料由G元素和C元素组成,其化学式为 。
X、Y、Z、W是元素周期表中前30号元素,且原子序数依次增大。其相关信息如下表:
| 元素 |
相关信息 |
| X |
X原子基态时最外层电子数是其内层电子总数的2倍 |
| Y |
Y的基态原子最外层电子排布式为nsnnpn+2 |
| Z |
Z元素的最高正价与负价代数和为6 |
| W |
W基态原子未成对电子数是前30号元素中最多的 |
(1)W位于元素周期表第 周期第 族,其基态原子最外层有 个电子。
(2)X的第一电离能比Y的 (填“大”或“小”),1mol X22-中含有的 键数目为 。
键数目为 。
(3)X和Y的气态氢化物中,较稳定的是 (写化学式),Y的同族元素(包括Y)的最简单氢化物中沸点最低的是 。
(4)写出KZY3与HZ浓溶液反应制取Z2的化学方程式,并标出电子转移的方向和数目 。
(5)已知:X(s)+Y2(g)=XY2(g) ΔH 1= -393.5 kJ•mol-1
XY(g) +1/2Y2(g)=XY2(g) ΔH 2= -282.9 kJ•mol-1
则X(s)与Y2(g)反应生成XY(g)的热化学反应方程式为 。
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(1)X氢化物的电子式是_________________________________________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是_____________________________________.
(3)Y—AgO电池是应用广泛的鱼雷电池,其原理如图所示。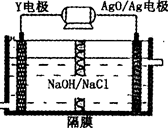
该电池的负极反应式是___________________________________。
(4)Z和W比较,非金属性较弱的是_______________(填元素符号),下列不能验证这一结论的是________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1 mol H—Z或H—W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
A、B、C、D、E为五种常见的短周期元素,常温下,A、B可形成B2A2和B2A两种液态化合物,B与D可组成分子X,X水溶液呈碱性,C元素的焰色反应呈黄色,E与C同周期,且E的简单离子半径是同周期元素形成的简单离子中半径最小的。试回答:
(1)D元素在周期表中的位置为 。
(2)B2 A和X的分子结合质子的能力不同,只用一个离子方程式就能证明,写出该离子反应方程式 。
(3)A、D、E三种元素形成的盐(化学式A9D3E)的水溶液呈酸性,用离子方程式解释其原因 ;
(4)W、Q是由A、B、C、D四种元素中任意三种组成的不同类型的强电解质,常温下0.1mol·L—1W的水溶液的pH为13,Q的水溶液呈酸性且能和W反应放出气体,物质的量浓度相同的 W、Q溶液中水的电离程度是前者小于后者。则:W为 ,Q为 (填化学式)。
(5)B和E形成的化合物E2B6常在有机合成中作强还原剂,甚至可将二氧化碳重新还原成甲烷,写出该反应方程式 。
(6)已知工业合成X的反应方程式:D2 (g)+3B2 (g) 2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
2X(g);△H ="-92.4" kJ·mol-1,在适当的催化剂和恒温恒压条件下反应,下列说法正确的有 。
A.达到化学平衡时,正逆反应速率相等
B.反应过程中不断分离出X,使平衡常数K减小,平衡正向移动有利于合成X
C.达到平衡后,升高温度,平衡常数K增大,B2的转化率降低
D.达到化学平衡的过程中,气体平均相对分子质量减小
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
五种元素原子半径最大是(写元素符号)
X与Z形成的化合物中,既含极性键又含非极性键的是(写分子式)————
由以上某些元素组成的化合物A、B、C、D有如下转化关系

①其中C是溶于水显酸性的气体;D是淡黄色固体。写出C与D反应的化学方程式
②如果A由四种元素组成、B均由三种元素组成,B为两性不溶物,则A为(填名称)
由A与过量C反应转化为B的离子方程式
③如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。则B为(填化学式) 。A、B浓度均为0.1mol/L的混合溶液,碱性较强的是(填溶液名称)
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。请回答下列问题:
(1)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示) 。 (2)由A、B两种元素以原子个数比5∶1形成离子化合物X,X的电子式为 。
(3)由A、B元素形成的化合物B2A4可以与O2、KOH溶液形成原电池,该原电池负极的电极反应式为 。
(4)①若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式: 。②若E是非金属元素,其单质在电子工业中有重要应用,其氧化物晶体中E原子的杂化方式为 。 (5)由A、C、D、F四种元素形成的化合物Y(DAFC3)(已知A2FC3的Ka1=1.3×10-2、Ka2=6.3×10-8),则Y溶液中各离子浓度由大到小的顺序为 ;向Y溶液中加入一定量的NaOH,使溶液中c(AFC3-)=c(FC32-),则此时溶液呈 (填“酸性”、“碱性”或“中性”);用惰性电极电解Y的水溶液,阳极无气体产生,阳极的电极反应式为 。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素是原子半径最小的原子;B元素的最高价氧化物对应水化物与其氢化物生成一种盐X;D与A同主族,且与E同周期;E元素的最外层电子数是其次外层电子数的3/4,A、B、D、E这四种元素,每一种与C元素都能形成元素的原子个数比不相同的若干种化合物。请回答下列问题:
(1)C和E两元素相比较,非金属性较强的是 (填元素名称),可以验证该结论的是 (填写编号)
A.比较这两种元素的气态氢化物的沸点
B.比较这两种元素的原子的电子层数
C.比较这两种元素的气态氢化物的稳定性
D.比较这两种元素的单质与氢化合的难易
(2)C、D两元素形成的原子个数比为1:1的化合物与C、E两元素形成的两种化合物都能反应,且有一种共同的产物,写出这两个反应的化学方程式: ; 。
(3)某工业生产的核心反应是 :2EC2(g) + C2(g)  2EC3(g) △H<0,回答下列问题:
2EC3(g) △H<0,回答下列问题:
①此反应的平衡常数表达式为K= ,随着温度的升高,上述平衡常数
(填“增大”、“减小”或“不变”)。
②将一定量的EC2(g)和C2(g)放入1L密闭容器中,在一定条件下达到平衡,测得EC2为0.11mol,C2为0.05mol,EC3为0.12mol。计算该条件下,反应的平衡常数K= 。EC2的转化为EC3转化率= 。
(4)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为 ;
(5)①在火箭推进器中装有液态B2A4和液态A2C2,已知0.4mol.液态B2A4和足量液态A2C2反应,生成气态B2和气态A2C,放出256.6kJ的热量。试写出该反应的热化学方程式: 。
②B2A4又称为肼,是一种可燃性液体,肼一空气燃料电池是一种碱性燃料电池,电解质溶液是20%—30%的KOH溶液,该电池放电时的电极反应式为:正极 ,负极
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中,T所处的周期序数与主族序数相等,请回答下列问题:
(1)T的原子结构示意图为
(2)元素的非金属性为(原子的得电子能力):Q ______ W(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为 。
(4)原子序数比R多1的元素的一种氢化物能分解为它的另一种氢化物,此分解反应的化学方程式是 。
(5)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2L的甲气体与0.5L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的R的含氧酸盐只有一种,则该含氧酸盐的化学式是
(6)在298K下,Q、T的单质各1mol完全燃烧,分别放出热量aKJ和bKJ。又知一定条件下,T的单质能将Q从它的最高价氧化物中置换出来,若此置换反应生成3molQ的单质,则该反应在298K下的 = ( 注:题中所涉单质均为最稳定单质)。
= ( 注:题中所涉单质均为最稳定单质)。
X、Y、Z、M、Q、G六种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,Y的一种同位素原子常用于测定文物的年代;Q形成的单质为淡黄色固体。请回答下列问题(涉及物质均用化学式表示)。
(1)离子化合物ZX中X离子的结构示意图为 ; Y在元素周期表中的位置是_______________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______________,Q与G的气态氢化物还原性更强的是__________________。
(3)工业上制备M的高纯度单质,其中一个重要反应是:由MXG3与X2在高温下反应。该反应过程必须控制无水无氧,因为MXG3遇水剧烈反应生成H2、 和 ,而混入氧气,引起的后果是 。
(4)X2Q的燃烧热为a kJ·mol-1,下列X2Q燃烧反应的热化学方程式正确的是 。
| A.2X2Q(g) + O2(g) =" 2Q(s)" + 2X2O(g)△H=" -2a" kJ·mol-1 |
| B.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" +a" kJ·mol-1 |
| C.2X2Q(g)+ 3O2(g) = 2QO2(g) + 2X2O(l)△H=" -2a" kJ·mol-1 |
| D.X2Q(g) + 2O2(g) = QO3(g) + X2O(l)△H=" -a" kJ·mol-1 |
(5)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z + FeG2 Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。
Fe + 2ZG 放电时,电池的正极反应式为: 该电池的电解质为___________________。

下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,用化学用语回答下列问题:
Ⅰ.(1)请画出元素⑧的阴离子结构示意图 。
(2)④、⑤、⑦的原子半径由小到大的顺序为 。
(3)⑤和⑥的最高价氧化物对应水化物的碱性强弱为 > 。
(4)④、⑤两种元素的原子按1:1组成的常见化合物的电子式为 。
Ⅱ.由表中①一⑧中的一种或几种元素形成的常见物质A、B、C可发生以下反应(副产物已略去),试回答:
(1)若X是一种常见过渡金属单质,向C的水溶液中滴加AgNO3溶液,产生不溶于稀HNO3的白色沉淀,检验此C溶液中金属离子的方法是 ;又知在酸性溶液中该金属离子能被双氧水氧化,写出该反应的离子方程式 。
(2)若A、B、C为含有同一金属元素的无机化合物,X为强电解质,A溶液与C溶液反应生成B,则B的化学式为 ,写出A与C两溶液反应的离子方程式____ 。
A、B、C、D、E、F六种短周期元素,其原子序数依次增大,其中B与C同周期,D与E和F同周期,A与D同主族,C与F同主族,C元素的原子最外层电子数是次外层电子数的三倍,D是所在周期原子半径最大的主族元素。又知六种元素所形成的常见单质在常温常压下有三种是气体,三种是固体。
请回答下列问题:
(1)元素D在周期表中的位置_______________________。
(2)C、D、F三种元素形成的简单离子的半径由大到小的顺序是(用离子符号表示)___________.
(3)由A、B、C三种元素以原子个数比4 :2 :3形成化合物X,X中所含化学键类型有________________.
(4)若E是金属元素,其单质与氧化铁反应常用于焊接钢轨,请写出反应的化学方程式:____________;若E是非金属元素,其单质在电子工业中有重要应用,请写出其氧化物溶于强碱溶液的离子方程式:________________。
(5)FC2气体有毒,排放到大气中易形成酸雨,写出FC2与氧气和水蒸气反应的化学方________________。
A、B、C、D是四种短周期元素,它们的原子序数依次增大。其中A、D元素同主族,B、C元素同周期;由A、B、C、D中的两种元素可形成原子个数比为1:1的多种化合物,甲、乙、丙、丁为其中的四种,它们的元素组成如下表所示:
常温下,甲物质为气体,密度略小于空气;乙物质为液体;丙物质和丁物质为固体且都为离子化合物。请填写下列空白:
(1)D元素形成的简单离子的结构示意图为 ,丙物质的化学式为 ,丁物质中阴离子与阳离子的个数之比为 。
(2)若标准状况下5.6L甲物质完全燃烧放出的热量为QKJ,试写出表示甲物质燃烧热的热化学方程式 。
(3)研究表明乙物质具有弱酸性,则乙物质在水中的电离方程式为 。
(4)B、C两种元素按原子个数比为1:2可形成化合物戊,A、C、D三种元素按原子个数比为1:1:1可形成化合物己,则戊与己按物质的量3:4反应后溶液中溶质为 。
(5)某同学设计了一个以结构简式是BA3-CA物质为燃料的电池,并用该电池电解200mL一定浓度NaCl与CuSO4混合溶液,其装置如下:
①写出ⅰ中通入该物质这一极的电极反应式 。
②理论上ⅱ中两极所得气体的体积随时间变化的关系如坐标图所示(气体体积已换算成标准状况下的体积),写出在t1后,石墨电极上的电极反应式 ;在t2时所得溶液的H+ 浓度约为 。
X、Y、Z、W四种常见元素,其中X、Y、Z为短周期元素。有关信息如下表:
| |
原子或分子相关信息 |
单质及其化合物相关信息 |
| X |
ZX4分子是由粗Z提纯Z的中间产物 |
X的最高价氧化物对应的水化物为无机酸中最强酸 |
| Y |
Y原子的最外层电子数等于电子层数 |
Y的氧化物是典型的两性氧化物,可用于制造一种极有前途的高温材料 |
| Z |
Z原子的最外层电子数是次外层电子数的1/2 |
Z是无机非金属材料的主角,其单质是制取大规模集成电路的主要原料 |
| W |
W原子的最外层电子数小于4 |
W的常见化合价有+3、+2,WX3稀溶液呈黄色 |
(1)W在周期表的位置为 ,W(OH)2在空气中不稳定,极易被氧化,由白色迅速变成灰绿色,最后变成红褐色,反应的化学方程式为 。
(2)X的简单阴离子的结构示意图为 ,X的最高价氧化物对应水化物的水溶液与Y的氧化物反应的离子方程式为 。
(3)Z的氧化物在通讯领域用来作 ,工业上制备Z的单质的化学反应方程式为 。锗与Z是同一主族元素,门捷列夫曾预言了这一元素的存在,它用来制造半导体晶体管,最新研究表明:有机锗具有明显的抗肿瘤活性,锗不与NaOH 溶液反应但在有H2O2存在时可与NaOH 溶液反应生成锗酸盐,其方程式为 。
(4)在50 mL l mol·L-1的YX3溶液中逐滴加入0.5 mol·L-1的NaOH溶液,得到1.56 g沉淀,则加入NaOH溶液的体积最多为 mL。
X、Y、Z、L、M、N是六种原子序数依次增大的前四周期元素。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。N的核电荷数比L的核电荷数的3倍多2, 回答下列问题:
(1)X和Y可以形成10电子、14电子、18电子分子,写出X元素质子数和中子数相等的核素的符号 。由X和Y元素组成的14电子分子的电子式为 。
(2)在水溶液中 将Fe3+还原为Fe2+,
将Fe3+还原为Fe2+, +4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
+4Fe3+→4Fe2++……其中化学反应式中的部分物质计量数已给出,该反应的离子方程式为______________________________。
(3)一定条件下,M与TiO2、C(石墨)反应只生成M的氧化物和碳化钛(TiC),二者均为某些高温结构陶瓷的主要成分。已知。该反应生成lmol M的氧化物时放出536kJ的热量,其热化学方程式为 。
(4)Z元素的气态氢化物和最高价氧化物对应的水化物化合生成一种盐,该盐的水溶液呈 (填“酸”、“碱”或“中”)性,该水溶液中各离子浓度由小到大的顺序 。
(5)N的低价硫酸盐溶液与过氧化钠反应。若N的低价硫酸盐与过氧化钠的物质的量之比为2:1,且无气体生成,则该反应的离子方程式为 。
X,Y,Z,Q,R是五种短周期元素,原子序数依次增大.X,Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z,R分别是地壳中含量最高的非金属元素和金属元素.请回答下列问题:
(1)上述元素原子半径由大到小的顺序是(写元素符号)
(2)X,Y,Z能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写名称)
该物质能使酸性高锰酸钾溶液褪色同时生成一种生活中常见有机物,此过程的离子方程式为
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系
其中C是溶于水显酸性的气体;D是淡黄色固体.
写出C的结构式 ;
①如果A,B均由三种元素组成,B为两性不溶物,则由A转化为B的离子方程式
②如果A由三种元素组成,B由四种元素组成,A,B溶液均显碱性.用离子方程式表示A溶液显碱性的原因 . A,B浓度均为0.1mol/L的混合溶液中,离子浓度由大到小的顺序是 ;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有
试题篮
()