中国首个空间实验室——“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),它是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,a、b、c、d均为Pt电极。下列说法正确的是( )

A.B区的OH-通过隔膜向a电极移动,A区pH增大
B.图中右管中的OH-通过隔膜向c电极移动,d电极上发生还原反应
C.c是正极,电极上的电极反应为:2H++2e-=H2↑
D.当有1mol电子转移时,b电极产生气体Y的体积为11.2L
近年来科学家研制了一种新型的乙醇电池(DEFC),它用磺酸类质子作溶剂,在200℃左右时供电,乙醇电池比甲醇电池效率高出32倍且更加安全.电池总反应式为:C2H5OH+3O 2 →2CO 2+ 3H2O.下列说法不正确的是( )
A.1mol乙醇被氧化转移6mol电子
B.C2H5OH在电池的负极上参加反应
C.在外电路中电子由负极沿导线流向正极
D.电池正极的电极反应式为4H++O2+4e-=2H2O
以葡萄糖为燃料的微生物燃料电池示意图如图所示。
关于该电池的叙述正确的是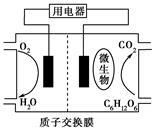
| A.该电池能够在高温下工作 |
| B.电池的负极反应为: C6H12O6+6H2O-24e-=6CO2↑+24H+ |
| C.放电过程中,H+从正极区向负极区迁移 |
D.在电池反应中,每消耗1 mol氧气,理论上能生成标准状况下CO2气体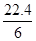 L L |
近来,制备和利用氢气这一清洁能源已有多项成果。
(1)德国克莱斯公司成功研制了甲醇(CH3OH)制氢车载燃料电池工艺,其原理如下流程图所示:

①流程图中,甲醇与水在选择氧化器中反应生成二氧化碳和氢气,写出该反应的化学方程式
②该车载燃料电池的介质为碱性环境,请写出该燃料电池的正极反应式为
(2)美国Bay等工厂成功研制了以甲烷来制取氢气,其生产流程如下图:

①此流程的第Ⅱ步反应为:CO(g)+H2O(g) H2(g)+CO2(g),该反应的化学平衡常数表达式K=
H2(g)+CO2(g),该反应的化学平衡常数表达式K=
②此流程的第Ⅱ步反应的平衡常数随温度的变化如下表,在830 ℃、以表中的物质的量(单位为mol)投入恒容反应器发生上述反应,其中反应开始时,向正反应方向进行的有________(填实验编号)。
| 温度/℃ |
400 |
500 |
830 |
1 000 |
| 平衡常数K |
10 |
9 |
1 |
0.6 |
| 实验编号 |
n(CO) |
n(H2O) |
n(H2) |
n(CO2) |
| A |
1 |
5 |
2 |
3 |
| B |
2 |
2 |
1 |
1 |
| C |
3 |
3 |
0 |
0 |
| D |
0.5 |
2 |
1 |
1 |
③若400 ℃时,第Ⅱ步反应生成1 mol氢气的热效应值为33.2kJ,第Ⅰ步反应的热化学方程式为:CH4(g) + H2O(g) === 3H2(g) + CO(g) ΔH=-103.3 kJ·mol-1则400 ℃时,甲烷和水蒸反应生成二氧化碳和氢气的热化学方程式为:
(3)我国科学家研究了常温下利用Pt等催化剂在可见光作用下使水分解制氢气的方法,下图是三种催化剂在光照分解水实验中的效果比较图。

要得出如图所示的实验结果,需要测定的实验数据是 ,本实验的目的是 。
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料。
(1)纳米级的Cu2O可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu2O并通入0.10mol水蒸气发生反应:
2H2O(g) 2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时段产生O2的量见下表:
2H2(g)+O2(g)△H=+484kJ•mol﹣1,不同时段产生O2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
上述反应过程中能量转化形式为光能转化为 能,达平衡过程中至少需要吸收光能为 kJ(保留三位小数)。
(2)氢气是合成氨工业的原料,合成塔中每产生2mol NH3,放出92.2kJ热量.已知:

则1mol N﹣H键断裂吸收的能量约等于 。
(3)已知:2H2(g)+O2(g)═2H2O(g)△H=﹣483.6kJ/mol
N2(g)+2O2(g)═2NO2(g)△H=+67.7kJ/mol
则H2还原NO2生成水蒸气和氮气反应的热化学方程式是 。
(4)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是 H2+2NiO(OH)  2Ni(OH)2。请由总反应式回答:
2Ni(OH)2。请由总反应式回答:
1.电解质溶液应该是 (选填酸溶液、碱溶液),
②.电池放电时,负极反应式为 ,
3.外电路中每通过0.2NA个电子时,H2的质量理论上减小 g,
4.电池工作时,电子由 极通过外电路流向 极(选填正、负)。
LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车。电池反应为:FePO4+Li LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质。下列有关LiFePO4电池说法正确的是
| A.可加入硫酸以提高电解质的导电性 |
| B.放电时电池内部Li+向负极移动 |
| C.充电过程中,电池正极材料的质量不变 |
| D.放电时电池正极反应为:FePO4+Li++e-=LiFePO4 |
由NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使在过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是( )

| A.石墨I极为正极,石墨II极为负极 |
| B.Y的化学式可能为NO |
| C.石墨I极的电极反应式为NO2+NO3――e-═N2O5 |
| D.石墨II极上发生氧化反应 |
已知某碱性硼化钒(VB3)一空气电池工作时发生反应为:11O2+4VB2=2V2O5+4B2O3。以该电池作为电源,使用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是
| A.VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+ |
| B.若B装置内的液体体积为400mL,则CuSO4溶液的物质的量浓度为0.025mol/L |
| C.电解过程中,b电极表面先有红色物质析出,然后有气泡产生 |
| D.外电路中电子由a电极流向b电极 |
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )

A.当有0.1 mol电子转移时,a极产生1.12 L O2(标况)
B.b极上发生的电极反应是:2H + 2e- = H2↑
+ 2e- = H2↑
C.d极上发生的电极反应是:O2 + 4H+ + 4e- = 2H2O
D.c极上进行还原反应,B中的H+可以通过隔膜进入A
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为: 4VB2 + 11O2→4B2O3 + 2V2O5。下列说法正确的是( )

| A.电极a为电池负极 |
| B.VB2中V的化合价为+4价 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为:2VB2 + 22OH−-22e−=V2O5 + 2B2O3 + 11H2O |
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效 率的特点.右图为氢氧燃料电池的结构示意图,电解质溶液为KOH 溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连 续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
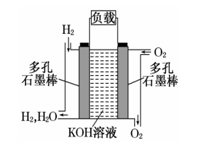
(1)写出氢氧燃料电池工作时负极反应方程式:
负极: 。
(2)为了获得氢 气,除了充分利用太阳能外,工业上利用石油产品与水在高温、催化剂作用下制取氢气.写出丙烷和 H2O 反应生成 H2 和 CO 的化学方程式:
(3)若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为 : 电池总离子反应方程式为 。
(4)若将此燃料电池改进为直接以有机物 A 和氧气为原料进行工作,有机物 A 只含有 C、H、 O 三种元素,常用作有机合成的中间体。16.8 g 该有机物经燃烧生成 44.0 g CO2 和 14.4 g H2O ;质谱图表明其相对分子质量为 84,红外光谱分析表明 A 分子中含有 O—H 键和位于分子端的-C≡C-键,核磁共振氢谱有三个峰,峰面积为 6:1:1。A 的分子式是 A的结构简式是
甲醇燃料电池是目前开发最成功的燃料电池之一,这种燃料电池由甲醇、空气(氧气)、KOH(电解质溶液)构成.电池的总反应式为2CH3OH+3O2+4OH-═2CO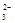 +6H2O.则下列说法正确的是
+6H2O.则下列说法正确的是
| A.电池放电时通入空气的电极为负极 |
| B.电池放电时负极的电极反应式为CH3OH-6e-+H2O═CO2↑+6H+ |
C.由于CO 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 水解显碱性,电池放电时,电解质溶液的pH逐渐增大 |
| D.电池放电时每消耗1molCH3OH转移6mol电子 |
工业废水随意排放会造成严重污染,根据成分不同可采用不同的处理方法。
(1)电池生产工业废水中常含有Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去。已知室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2。
①请用离子方程式说明上述除杂的原理______________________。
②FeS高温煅烧产生的SO2气体通入下列溶液中,能够产生沉淀的是_________(填序号)
A.Ba(NO3)2 B.BaCl2
C.Ba(OH)2 D.溶有NH3的BaCl2溶液
③已知元素在高价态时常表现氧化性,若在酸性CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀,则生成CuCl的离子方程式是___________。
(2)电解法处理酸性含铬废水(主要含有Cr2O72-)时,在废水中加入适量NaCl,以铁板作阴、阳极,处理过程中存在如下反应Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,最后Cr3+ 以Cr(OH)3形式除去,下列说法不正确的是______(填序号)
A.阳极反应为Fe-2e-═Fe2+
B.电解过程中溶液pH减小
C.过程中有Fe(OH)3沉淀生成
D.电路中每转移12 mol电子,最多有2mol Cr2O72-被还原
(3)废氨水可以转化成氨,氨再设计成碱性燃料电池。右图是该燃料电池示意图,产生的X气体可直接排放到大气中,a电极作_________极(填“正”“负”“阴”或“阳”),其电极反应式为___________。

镁-空气电池的工作原理如右图所示。下列说法不正确的是( )

| A.工作一段时间后,c(Na+)变大 | B.电池工作时,OH-向a极移动 |
| C.气体X 中N2的百分含量与空气相同 | D.电池总反应为2Mg+O2+2H2O=2Mg(OH)2 |
Li﹣Al/FeS电池是一种正在开发的电动车用二次电池,该电池反应式为:2Al+6Li++3FeS=2Al3++3Li2S+3Fe.有关该电池的下列说法中,错误的是( )
| A.作为二次电源,该电池在使用的过程中至少存在3种形式的能量转化 |
| B.Li﹣Al在电池中作为负极材料,负极的电极反应式为Li﹣e﹣=Li+ |
| C.该电池替代现在电动车广泛使用的铅蓄电池可以减少重金属的污染 |
| D.充电时,阳极发生的电极反应式为:Li2S+Fe﹣2e﹣=2Li++FeS |
试题篮
()