下图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1)图中通过负载的电子流动方向______(填“向左”或“向右”).
(2)写出氢氧燃料电池工作时电极反应方程式和总反应方程式.
负极:___________________________,总反应:________________________.
已知铅蓄电池的工作原理为Pb+PbO2+2H2SO4 2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
2PbSO4+2H2O,现用如图装置进行电解(电解液足量),测得当 铅蓄电池中转移0.4 mol电子时铁电极的质量减少11.2 g。请回答 下列问题。
(1)A是铅蓄电池的 极,铅蓄电池正极反应式为 ,放电过程中电解液的密度 (填“减小”、“增大”或“不变”)。
(2)Ag电极的电极反应式是 ,该电极的电极产物共 g。
(3)Cu电极的电极反应式是 ,CuSO4溶液的浓度 (填“减小”、“增大”或“不变”)
(4)如图表示电解进行过程中某个量(纵坐标x)随时间的变化曲线,则x表示 。
a.各U形管中产生的气体的体积
b.各U形管中阳极质量的减少量
c.各U形管中阴极质量的增加量
氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:
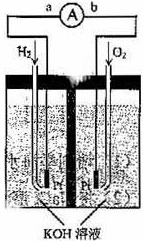
(1)氢氧燃料电池的能量转化的主要形式是_________________,在导线中电子流动方向为____________(用a、b表示)。
(2)负极反应式为______________________________________。
(3)电极表面镀铂粉的原因是____________________________。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.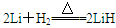 Ⅱ.LiH+H2O===LiOH+H2↑
Ⅱ.LiH+H2O===LiOH+H2↑
①反应Ⅰ中的还原剂是___________,反应Ⅱ中的氧化剂是____________。
②LiH中Li+与H-的半径大小关系为
③用锂吸收224 L(标准状况)H2生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为________mol。
氮元素的氢化物和氧化物在工业生产和国防建设中都有广泛应用,回答下列问题:
(1)氮元素原子的L层电子数为 ;肼的结构式:
(2)NH3与NaClO反应可得到肼(N2H4),该反应的化学方程式为 ;
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4(l)反应生成N2和水蒸气。
已知:①N2(g)+2O2(g)= N2O4(1) △H1= -195kJ·mol-1
②N2H4(1) + O2(g)= N2(g) + 2H2O(g) △H2= -534.2kJ·mol-1
写出N2H4(1)和N2O4(1) 反应生成N2和水蒸气的热化学方程式 ;
(4)肼一空气燃料电池是一种具有高效,环境友好的碱性电池,,该电池放电时,负极的反应式为 。
(10分)阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池总反应为:2H2+O2===2H2O.试回答下列问题:
(1)若电解质溶液为KOH溶液,构成燃料电池,则:
①负极反应式为________________,
②工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(2)如把KOH改为稀H2SO4作电解质,则:
①正极反应式为________________,
②工作一段时间后,溶液pH________(填“增大”或“减小”或“不变”).
(3)如把H2改为甲烷,KOH作电解质,则正极反应式为____________________.
已知化学能与其他形式的能可以相互转化。填写下表的空白:
| 化学反应方程式(例子) |
能量转化形式 |
| ① |
由化学能转化为热能 |
②Pb+PbO2+2H2SO4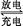 2PbSO4+2H2O 2PbSO4+2H2O |
|
③CaCO3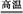 CaO+CO2↑ CaO+CO2↑ |
|
上述反应中属于氧化还原反应的是(填序号) 。
氢氧燃料电池是将H2通入负极,O2通入正极而发生电池反应的,其能量转换率高。
(1)若电解质溶液为KOH溶液,其正极反应为 ,负极反应为 ;
(2)若电解质溶液为硫酸,其正极反应为 ,负极反应为 ;
若反应过程中转移了2mol电子,可产生水的质量为 g。
(3)若用氢氧燃料电池电解由NaCl和CuSO4组成的混合溶液,其中c(Na+)=3c(Cu2+)
=0.3mol·L—1,取该混合液100mL用石墨做电极进行电解,通电一段时间后,在阴极收集到0.112L(标准状况)气体。此时氢氧燃料电池外电路中转移电子数为 ,消耗H2的质量为 。
Ⅰ.下图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少;甲池中发生的反应为:
CH4 +2O2 + 2KOH = K2CO3+ 3H2O 。回答下列问题:

(1) M 电极材料是 ,N电极的电极反应式为 ,通入甲烷的铂电极上发生的电极反应式为 __________ _ 。
(2)在此过程中,乙池中某一电极析出金属银4.32g 时,甲池中理论上消耗标准状况下的氧气体积为 L;若此时乙池溶液的体积为400mL,则乙池溶液中的H+的物质的量浓度为 。
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
I:CH4(g) + H2O (g) =CO(g) + 3H2(g) △H =+206.0 kJ/mol
II:CO (g) + 2H2 (g) = CH3OH (g) △H =—129.0 kJ/mol
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为_______________。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图

假设100 ℃时达到平衡所需的时间为15min,则用H2表示该反应的平均反应速率为_______________。
(3)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式:______________。
(4)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成Co3+,然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。实验室用下图装置模拟上述过程:

① 写出阳极电极反应式_______________。
② 写出除去甲醇的离子方程式_________________。
(1)写出下列化合物的结构简式
2,2,3,3,-四甲基戊烷:__________________________。
(2)①写出Na2CO3溶液与AlCl3溶液反应的离子方程__________________________。
②写出由甲苯制备TNT的化学方程式:__________________________。
③Na2CO3溶液显碱性,用离子方程式表示原因___________,其溶液中离子浓度大小顺序为___________。
(3)除去括号中的杂质,填上适宜的试剂和提纯方法
乙醇(水):__________、_________。
(4)甲烷燃料电池(在KOH环境中)的负极的电极反应式:___________________。
(5)将煤转化为煤气的主要化学反应为:C(s)+H2O(g)===CO(g)+H2(g)
C(s)、CO(g)和H2(g)完全燃烧的热化学方程式为:
C(s)+O2(g)===CO2(g) ΔH=-393.5 kJ/mol
H2(g)+ O2(g)===H2O(g) ΔH=-242.0 kJ/mol
O2(g)===H2O(g) ΔH=-242.0 kJ/mol
CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ/mol
O2(g)===CO2(g) ΔH=-283.0 kJ/mol
根据以上数据,写出C(s)与水蒸气反应的热化学方程______________________。
写出下列电极方程式书写:
(1)酸性电解质的条件下氢氧燃料电池负极的电极方程式 ;正极的电极方程式 ;
(2)氢氧化钾做电解质条件下写出甲醇(CH3OH)的燃料电池的负极的电极方程式 ;正极的电极方程式 ;
(3)写出碱性锌锰原电池的负极的电极方程式 ;正极的电极方程式 ;
(4)写出铅蓄电池放电的负极的电极反应方程式 ;
Ⅰ(1)CO可用于炼铁,已知Fe2O3(s)+ 3C(s)=2Fe(s)+ 3CO(g) ΔH 1=+489.0 kJ·mol-1,C(s) +CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
Ⅱ(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:负极的电极反应式是 。
(3)下图是一个电化学过程示意图。

①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍(Ni)镉(Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,负极材料是 ,以下说法中正确的是 (填字母代号)
| A.①③ | B.②④ | C.①④ | D.②③ |
①以上反应是可逆反应 ②充电时镍元素被氧化
③电子由正极经电解质溶液流向负极 ④放电时电能转变为化学能
(2)写出放电时正极电极反应:
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni Cd)电池,其电池总反应可以表示为:
Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O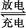 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法中正确的是( )
①以上反应是可逆反应
②以上反应不是可逆反应
③充电时化学能转变为电能
④放电时化学能转变为电能
| A.①③ | B.②④ | C.①④ | D.②③ |
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明一节废镍镉电池可以使一平方米面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重。这是因为 。
试题篮
()