下列有关电化学原理的说法中,错误的是
| A.在现实生活中,电化学腐蚀要比化学腐蚀严重的多,危害更大 |
| B.在铜的精炼装置中,通常用粗铜作作阳极,精铜作阴极 |
| C.氯碱工业,主要依托电解熔融的氯化钠来制取工业上重要的化工原料烧碱和氯气 |
| D.可充电的电池称“二次电池”,在充电时,是将电能转变成化学能,在放电时,又将化学能转化成电能 |
如图是铅蓄电池充、放电时的工作示意图,电解质是H2SO4溶液.已知放电时电池反应为:Pb+PbO2+4H++2SO42﹣═2PbSO4+2H2O.下列有关说法正确的是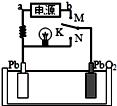
| A.K与N相接时,能量由电能转化为化学能 |
| B.K与N相接时,Pb上发生反应为:Pb-2e- = Pb2+ |
| C.K与M连接时,所用电源的a极为负极 |
| D.K与M连接时,PbO2上发生反应为:PbO2+4e_+4H++SO42﹣═PbSO4+2H2O |
500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)为6.0 mol•L-1,用石墨电极电解此溶液,当通电一段时间后,两极均收到22.4L气体(标准状况),假定电解后溶液体积仍为500mL,下列说法正确的是
| A.原混合溶液中c(K+)为4mol/L |
| B.原溶液中c(Cu2+)为1mol/L |
| C.电解后溶液中c(H+)为8mol/L |
| D.电解后加入1molCu(OH)2可使溶液复原 |
工业上常用电解硫酸钠溶液联合生产硫酸和烧碱溶液的装置如图所示,其中阴极和阳极均为惰性电极.测得同温同压下,气体甲与气体乙的体积比约为1:2,以下说法正确的是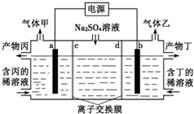
| A.a极与电源的负极相连 |
| B.产物丙为硫酸溶液 |
| C.离子交换膜d为阴离子交换膜 |
| D.a电极反应式:2H2O+2e-=H2↑+2OH- |
硼化钒(VB2)-空气电池是目前储电能力最高的电池,电池示意图如下,该电池工作时反应为:4VB2 + 11O2→ 4B2O3 + 2V2O5 。下列说法正确的是
| A.电极a为电池负极 |
| B.图中选择性透过膜只能让阳离子选择性透过 |
| C.电子由VB2极经KOH溶液流向a电极 |
| D.VB2极发生的电极反应为:2VB2 + 22OH−- 22e−→V2O5 + 2B2O3 + 11H2O |
(1)某课外活动小组同学用图1装置进行实验,试回答下列问题:


图1 图2
①若开始时开关K与a连接,则铁发生电化学腐蚀中的___________腐蚀。请写出正极反应式: 。
②若开始时开关K与b连接时,两极均有气体产生,则N端是电源的__________极(填正或负)则总反应的离子方程式为______________________
(2)该小组同学设想,用如图2所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠。
①制得的氢氧化钠溶液从出口(填“A”、“B”、“C”或“D”)___________导出。通过阴离子交换膜的离子数________ (填“>”、“<”或“=”)通过阳离子交换膜的离子数。
②通电开始后,阴极附近溶液pH会增大,请简述原因:_________________________
Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液(加入一定量酸),示意图如下。该电池工作时,下列说法正确的是
| A.Mg电极是该电池的正极 |
| B.电池总反应为Mg+H2O2+2H+=Mg2++ 2H2O |
| C.电池工作时,石墨周围海水的pH减少 |
| D.电池工作时,溶液中的H+向负极移动 |
(1)如图1是一种新燃料电池,它以CO为燃料,一定比例的Li2CO3和Na2CO3熔融混合物为电解质,图2是粗铜精炼的装置图,现用燃料电池为电源进行粗铜的精炼实验。
①写出A极发生的电极反应式______________________;
②要用燃料电池为电源进行粗铜的精炼实验,则B极应该与____________极(填:“C”或“D”)相连;
③当消耗1.12L(标况下)CO时,粗铜电极理论上减少铜的质量不超过__________克。
(2)工业上,可用铁作阳极,电解KOH溶液制备K2FeO4。
①电解过程中,OH-向_________(填“阴”或“阳”)极移动,阳极的电极反应式为______________;
②若阳极有28gFe溶解,则阴极析出的气体在标准状况下的体积为___________L。
下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO32-+I2+H2O”设计成原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是
AsO32-+I2+H2O”设计成原电池装置,其中C1、C2均为碳棒.甲组向图Ⅰ烧杯中逐滴加入适量浓盐酸;乙组向图ⅡB烧杯中逐滴加入适量40%NaOH溶液.下列叙述中正确的是
| A.甲组操作时,微安表(G)指针发生偏转 |
| B.甲组操作时,溶液颜色变浅 |
| C.乙组操作时,C2做正极 |
| D.乙组操作时,C1上发生的电极反应为I2+2e-═2I- |
将两个铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2,即可产生电流。下列叙述正确的是
①通入CH4的电极为正极;
②正极的电极反应式为:O2+2H2O+4e-=4OH-;
③通入CH4的电极反应式为:CH4+2O2+4e-=CO2+2H2O;
④负极的电极反应式为:CH4+10OH--8e-=CO32-+7H2O;
⑤放电时溶液中的阳离子向负极移动;
⑥放电时溶液中的阴离子向负极移动.
| A.①③⑤ | B.②④⑥ | C.④⑤⑥ | D.①②③ |
C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍。该电池的电池反应式为:NaMO2 + nC Na(1-x)MO2 + NaxCn,下列有关该电池的说法正确的是
Na(1-x)MO2 + NaxCn,下列有关该电池的说法正确的是
| A.电池放电时,溶液中钠离子向负极移动 |
B.该电池负极的电极反应为NaMO2-xe- Na(1-x)MO2+xNa+ Na(1-x)MO2+xNa+ |
| C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用钠时少 |
D.电池充电时的阳极反应式为:nC+xNa+-xe- NaxCn NaxCn |
科学家设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图所示。下列说法不正确的是
| A.通入N2的电极发生的电极反应式为:N2+6e-+8H+=2NH4+ |
| B.反应过程中溶液的pH会变大,故需要加入盐酸 |
| C.该电池外电路电流从通入H2的电极流向通入N2的电极 |
| D.通入H2的电极为负极,A为NH4Cl |
写出下列电极方程式书写:
(1)酸性电解质的条件下氢氧燃料电池负极的电极方程式 ;正极的电极方程式 ;
(2)氢氧化钾做电解质条件下写出甲醇(CH3OH)的燃料电池的负极的电极方程式 ;正极的电极方程式 ;
(3)写出碱性锌锰原电池的负极的电极方程式 ;正极的电极方程式 ;
(4)写出铅蓄电池放电的负极的电极反应方程式 ;
下图是一个化学过程的示意图。

(1)图中甲池中OH-移向 极(填“CH3OH”或“O2”)。
(2)写出通入CH3OH的电极的电极反应式: 。
(3)向乙池两电极附近滴加适量紫色石蕊试液,附近变红的电极为 极(填“A”或"B”),并写出此电极的反应式:____ 。
(4)乙池中总反应的离子方程式:____ 。
(5)当乙池中B(Ag)极的质量增加5.4g时,乙池的pH是 (若此时乙池中溶液的体积为500mL);此时丙池某电极析出1.60g某金属,则丙中的某盐溶液可能是 (填序号)。
| A.MgSO4 | B.CuSO4 | C.AgNO3 | D.AlCl3 |
Ⅰ.(1)工业上合成氨的反应:N2(g)+3H2(g) 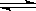 2NH3(g) ΔH=-92.60 kJ·mol-1。
2NH3(g) ΔH=-92.60 kJ·mol-1。
①恒温容积固定的密闭容器中发生反应:N2(g)+3H2(g) 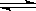 2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
2NH3(g),下列说法能说明上述反应达到平衡状态的是____________。
a.单位时间内生成2n mol NH3的同时生成3n mol H2
b.单位时间内生成6n mol N—H键的同时生成2n mol H—H键
c.用N2、H2、NH3的物质的量浓度变化表示的反应速率之比为1∶3∶2
d.混合气体的平均摩尔质量不变
e.容器内的气体密度不变
f.容器内气体的压强不变
(2)已知合成氨反应在某温度下2 L的密闭容器中进行,测得如下数据:
 时间(h) 时间(h)物质的量(mol) |
0 |
1 |
2 |
3 |
4 |
| N2 |
1.50 |
n1 |
1.20 |
n3 |
1.00 |
| H2 |
4.50 |
4.20 |
3.60 |
n4 |
3.00 |
| NH3 |
0 |
0.20 |
n2 |
1.00 |
1.00 |
根据表中数据计算:
①反应进行到2 h时放出的热量为________ kJ。
②0~1 h内N2的平均反应速率为________ mol·L-1·h-1。
③此温度下该反应的化学平衡常数K=________(保留两位小数)。
④反应达到平衡后,若往平衡体系中再加入N2、H2和NH3各1.00 mol,化学平衡将向________方向移动(填“正反应”或“逆反应”)。
Ⅱ.(1)二氧化碳是一种重要的温室气体,减少二氧化碳的排放是解决温室效应的有效途径。目前,由二氧化碳合成二甲醚的研究工作已取得了重大进展,其化学反应方程式为2CO2(g)+6H2(g) 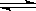 CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
CH3OCH3(g)+3H2O(g) ΔH>0。二甲醚气体的燃烧热为1 455 kJ·mol-1,工业上用合成气(CO、H2)直接或间接合成二甲醚。下列有关叙述正确的是________。
A.二甲醚分子中含极性共价键
B.二甲醚作为汽车燃料不会产生污染物
C.二甲醚是非极性分子 D.表示二甲醚燃烧热的热化学方程式为CH3OCH3(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-1 455 kJ·mol-1
(2)绿色电源“直接二甲醚燃料电池”的工作原理示意图如图所示:正极为________(填“A电极”或“B电极”),H+移动方向为:由 到 (填A或B),写出A电极的电极反应式:___________。

试题篮
()