如图是一种应用广泛的锂电池,LiPF6是电解质,SO(CH3)2是溶剂,反应原理是4Li+FeS2=Fe+2Li2S。下列说法正确的是
| A.该装置将电能转化为化学能 |
| B.Li+向a极移动 |
| C.可以用水代替SO(CH3)2做溶剂 |
| D.b极反应式是FeS2+4Li++4e-=Fe+2Li2S |
美国化学家设计出以甲烷等碳氢化合物为燃料的新型电池,其成本大大低于以氢为燃料的传统电池。燃料电池使用气体燃料和氧气直接反应产生电能,其效率高、污染低,是一种很有前途的能源利用方式。
(1)用KOH溶液做电解质,甲烷燃料电池的总反应方程式为______________;
(2)a是电池的____极,电极反应式为____________;
(3)标准状况时,通入甲烷1.12L,理论上通过导线的电子的数目为_______。
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________ 。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。 电池总离子反应方程式为_______________________________。
如图所示,通电5 min后,第③极增重2.16 g,同时在A池中收集到标准状况下的气体224 mL,设A池中原混合液的体积为200 mL,求通电前A池中原混合溶液Cu2+的浓度。
固体氧化物燃料电池(SOFC)以固体氧化物作为电解质。其工作原理如右图所示:下列关于固体燃料电池的有关说法正确的是
A.电极b为电池负极,电极反应式为O2+4e-=4O2-
B.固体氧化物的作用是让电子在电池内通过
C.若H2作为燃料气,则接触面上发生的反应为
H2+2OH--4e-=2H++H2O
D.若C2H4作为燃料气,则接触面上发生的反应为
C2H4+6O2--12e-=2CO2+2H2O
已知亚硫酰氯(SOCl2)溶于水产生大量白雾和刺激性气味气体.有一种锂电池,用锂与石墨作电极材料,电解质溶液是由四氯化铝锂(LiAlCl4)溶解在亚硫酰氯(SOCl2)中形成的,电池总反应方程式为8Li+3SOCl2=6LiCl+Li2SO3+2S。下列有关叙述中,正确的是
| A.锂为电池的正极,石墨作电池的负极 |
| B.电池工作过程中,亚硫酰氯(SOCl2)被还原为Li2SO3 |
| C.电解质溶液中混入水,对电池反应无影响 |
| D.电池工作过程中,锂提供的电子与正极区析出硫的物质的量之比为4:1 |
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2,下列有关说法正确的是( )
| A.锂电极作电池负极,放电过程中发生还原反应 |
| B.1 mol SOCl2发生电极反应转移的电子数为4 mol |
| C.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2 |
| D.组装该电池必须在无水、无氧的条件下进行 |
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s)。则下列说法正确的是( )
| A.电池工作时,MnO2发生还原反应 |
| B.电池负极的电极反应式为:2MnO2+H2O+2e-→Mn2O3+2OH- |
| C.电池工作时,K+移向负极 |
| D.电池工作时,电路中每通过0.1mol电子,锌的质量理论上减少6.5g |
(10分) 铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO2-4 2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):[来
2PbSO4+2H2O,请回答下列问题(不考虑氢、氧的氧化还原):[来
(1)放电时 :正极的电极反应式是 ;电解液中H2SO4的浓度将________(填变大、变小、不变);当外电路通过1 mol电子时,理论上负极板的质量增加________g。
:正极的电极反应式是 ;电解液中H2SO4的浓度将________(填变大、变小、不变);当外电路通过1 mol电子时,理论上负极板的质量增加________g。
(2)在完全放电耗尽PbO2和Pb时,若按图连接,电解一段时间后,则在A电极上生成_____、B电极上生成_____________,此时铅蓄电池的正负极的极性将________________。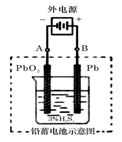
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷(C2H6)和氧气,有关此电池的推断错误的是
| A.通乙烷的电极为负极,电极反应为:C2H6+18OH――14e—=2CO32-+12H2O |
B.参加 反应的O2与C2H6的物质的量之比为7∶2 反应的O2与C2H6的物质的量之比为7∶2 |
| C.放电一段时间后,KOH的物质的量浓度将下降 |
D.放电一段时间后,正极 区附近溶液的pH减小 区附近溶液的pH减小 |
为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D−Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D−Zn-NiOOH二次电池,结构如下图所示。电池反应为
。下列说法错误的是( )
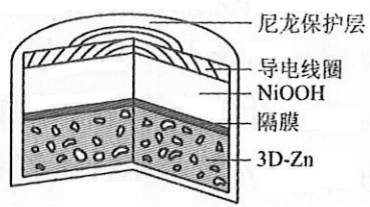
| A. |
三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高 |
| B. |
充电时阳极反应为 |
| C. |
放电时负极反应为 |
| D. |
放电过程中 通过隔膜从负极区移向正极区 |
锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:
Zn(s)+2MnO2(s)+H2O(l)=Zn(OH)2(s)+Mn2O3(s) 下列说法错误的是
| A.电池工作时,锌失去电子,电解液内部OH-向负极移动 |
| B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e-=Mn2O3(s)+2OH-(aq) |
| C.电池工作时,电子由正极通过外电路流向负极 |
| D.外电路中每通过0.2mol电子,锌的质量理论上减小6.5g |
据报道,最近摩托罗拉公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量可达现在使用的镍氢电池或锂电池的十倍,可连续使用一个月才充一次电。其电池反应为:
2CH3OH+3O2+4OH- 2CO32-+6H2O,则下列说法错误的是
2CO32-+6H2O,则下列说法错误的是
| A.放电时CH3OH参与反应的电极为正极 |
| B.充电时电解质溶液的pH逐渐增大 |
| C.放电时负极的电极反应式为:CH3OH-6e-+8OH-=CO32—+6H2O |
| D.充电时每生成1 mol CH3OH转移6 mol电子 |
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.下图为氢氧燃料电池的结构示意图,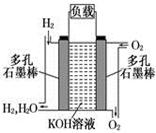
电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式: ___________ 。
(2)如果该氢氧燃料电池每转移0.1mol电子,消耗标准状况下___________L氧气。
(3) 若将此燃料电池改进为直接以甲烷和氧气为原料进行工作时,负极反应式为___________________。 电池总离子反应方程式为_______________________________。
试题篮
()