工业废水中常含有一定量的Cr2O,会对人类及生态系统产生很大损害,电解法是行之有效的除去铬的方法之一。该法用Fe和石墨作电极电解含Cr2O 的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。
的酸性废水,最终将铬转化为Cr(OH)3沉淀,达到净化目的。某科研小组利用以上方法处理污水,设计了熔融盐电池和污水电解装置如下图所示。
(1)Fe电极为 (填“M”或“N”);电解时 (填“能”或“不能”)否用Cu电极来代替Fe电极,理由是 。
(2)阳极附近溶液中,发生反应的离子方程式是
阴极附近的沉淀有 。
(3)图中熔融盐燃料电池是以熔融碳酸盐为电解质、CH4为燃料、空气为氧化剂、稀土金属材料为电极的新型电池。已知,该熔融盐电池的负极的电极反应是CH4–8e–+4CO32–==5CO2+2H2O,则正极的电极反应式为 。
(4)实验过程中,若电解池阴极材料质量不变,产生4.48L(标准状况)气体时,熔融盐燃料电池消耗CH4的体积为 L(标准状况)。
二氧化碳是引起“温室效应”的主要物质,节能减排、高效利用能源能够减少二氧化碳的排放。
(1)在一定温度下的2L固定容积的密闭容器中,通入2 mol CO2和3mol H2,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g) △H=-a kJ·mol-1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。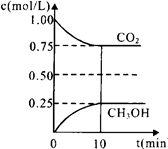
①能说明该反应已达平衡状态的是______ __。
A.CO2的体积分数在混合气体中保持不变
B.混合气体的密度不随时间的变化而变化。
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O。 D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
D.反应中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变。
②下列措施中能使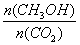 增大的是________(选填编号)。
增大的是________(选填编号)。
A.升高温度
B.恒温恒容下充入He(g) C.将H2O(g)从体系中分离
C.将H2O(g)从体系中分离
D.恒温恒容再充入2 mol CO2和3 mol H2
③计算该温度下此反应的平衡常数K=__________。若改变条件(填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
(2)某甲醇燃料电池原理如下图1所示。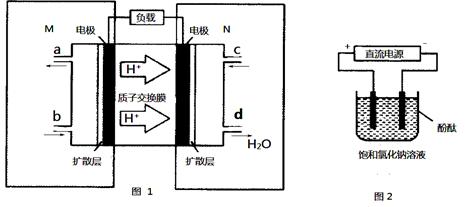
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用上图2装置电解饱和食盐水(电极均为惰性电极),则该电解反应的总反应的离子方程式为________________________。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
氨在国防、工农业等领域发挥着重要作用。
(1)工业以甲烷为原料生产氨气的过程如下:
①过程Ⅰ中,有关化学反应的能量变化如下图所示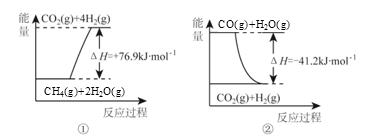
反应①为 反应(填“吸热”或“放热”),CH4 (g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式是 。
②CO可降低过程Ⅱ所用催化剂的催化效率,常用乙酸二氨合铜(Ⅰ)溶液吸收,其反应原理为: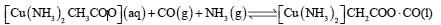 ,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是 。(选填字母)。
,所得溶液经处理的又可再生,恢复其吸收CO能力,再生的适宜条件是 。(选填字母)。
a.高温、高压 b.高温、低压
c.低温、低压 d.低温、高压
③下表是过程Ⅱ中,反应物的量相同时,不同条件下平衡体系中氨的体积分数
Ⅰ.根据表中数据,得出的结论是 。
Ⅱ.恒温时,将N2和H2的混合气体充入2L密闭容器中,10分钟后反应达到平衡时n(N2)= 0.1mol,
n(H2)= 0.3mol。下列图象能正确表示该过程中相关量的变化的是 。(选填字母)。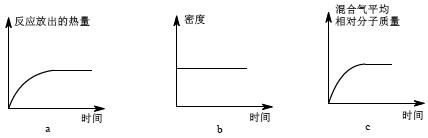
(2)直接供氨式固体氧化物燃料电池能量转化率达85%,其结构示意图如图所示:
①负极的电极反应式是______。
②用该电池电解300ml的饱和食盐水。一段时间后,溶液pH=13(忽略溶液体积的变化),则消耗NH3溶液的体积是_____L。(标准状况)
一氧化碳是一种用途广泛的化工基础原料。
(l)在高温下CO可将SO2还原为单质硫。已知:
2CO(g)+O2(g) 2CO2(g) △H1=-566.0kJ·mol-1;
2CO2(g) △H1=-566.0kJ·mol-1;
S(s)+O2(g) SO2(g) △H2=-296.0kJ·mol-1;
SO2(g) △H2=-296.0kJ·mol-1;
请写出CO还原SO2的热化学方程式______ 。
(2)工业上用一氧化碳制取氢气的反应为:CO(g)+H2O(g) CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
CO2(g)+H2(g),已知420℃时,该反应的化学平衡常数K=9。如果反应开始时,在2L的密闭容器中充入CO和H2O的物质的量都是0.60mol,5min末达到平衡,则此时CO的转化率为____,H2的平均生成速率为 mol·L-1min-1,其他条件不变时,升温至520℃,CO的转化率增大,该反应为____反应(填“吸热”或“放热”);
(3)CO与H2反应还可制备CH3OH,CH3OH可作为燃料使用,用CH3OH和O2组合形成的质子交换膜燃料电池的结构示意图
电池总反应为:2CH3OH+3O2=2CO2+4H2O,则c电极是 (填“正极”或“负极”),c电极的反应方程式为 。若用该电池电解精炼铜(杂质含有Ag和Fe),粗铜应该接此电源的____极(填“c”或“d”),反应过程中析出精铜64g,则上述CH3OH燃料电池,消耗的O2在标况下的体积为 L。
甲醇是一种重要的可再生能源。
(1)已知2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH ="a" KJ/mol
CO(g)+2H2(g)=CH3OH(g) ΔH ="b" KJ/mol
试写出由CH4和O2制取甲醇的热化学方程式: 。
(2)还可以通过下列反应制备甲醇:CO(g)+2H2(g)  CH3OH(g)。
CH3OH(g)。
甲图是反应时CO和CH3OH(g)的浓度随时间的变化情况。从反应开始到达平衡,用H2表示平均反应速率υ(H2)= _。
(3)在一容积可变的密闭容器中充入10 mol CO和20 mol H2,CO的平衡转化率随温度(T压强(P)的变化如乙图所示。
①下列说法能判断该反应达到化学平衡状态的是_______。(填字母)
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.体系中H2的转化率和CO的转化率相等
D.体系中气体的平均摩尔质量不再改变
②比较A、B两点压强大小PA________PB(填“>、<、=”)。
③若达到化学平衡状态A时,容器的体积为20 L。如果反应开始时仍充入10 molCO和20 molH2,则在平衡状态B时容器的体积V(B)= L。
(4)以甲醇为燃料,氧气为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极)。
①若KOH溶液足量,则写出电池总反应的离子方程式:___________________。
②若电解质溶液中KOH的物质的量为0.8 mol,当有0.5 mol甲醇参与反应时,电解质溶液中各种离子的物质的量浓度由大到小的顺序是 。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)CO2的电子式为: 。
(2)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式:(系数按顺序填在答题卷上)
___ C+ ___ KMnO4+ ____ H2SO4 = ____CO2↑+ ____MnSO4 + ____K2SO4+ ____H2O
(3)甲醇是一种新型燃料,工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+ 2H2(g) CH3OH(g) △H1=-116 kJ·mol-1
CH3OH(g) △H1=-116 kJ·mol-1
已知: △H2=-283 kJ·mol-1
△H2=-283 kJ·mol-1 △H3=-242 kJ·mol-1
△H3=-242 kJ·mol-1
则表示1mol气态甲醇完全燃烧生成CO 2和水蒸气时的热化学方程式为 ;
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的燃料电池装置。
①该电池负极的电极反应为: 。
②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为 。
(5)在容积为1L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律。下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为1mol)与CO平衡转化率的关系。利用图中a点对应的数据,计算出曲线Z在对应温度下 CO(g)+ 2H2(g) CH3OH(g)的平衡常数K = 。
CH3OH(g)的平衡常数K = 。
(6)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=2.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为5.6×10-5 mol/L ,则生成沉淀所需CaCl2溶液的最小浓度为 。
镁是海水中含量较多的金属,镁合金及其镁的化合物用途非常广泛。
(1)“镁-次氯酸盐”燃料电池的装置如下图所示: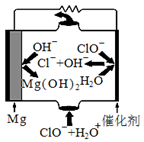
该电池的正极反应式为 。
(2)Mg2Ni是一种储氢合金,已知:
Mg(s) + H2(g) MgH2(s) △H1=-74.5kJ·mol-1
MgH2(s) △H1=-74.5kJ·mol-1
Mg2Ni(s) + 2H2(g) Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2NiH4(s) △H2=-64.4kJ·mol-1
Mg2Ni(s)+2MgH2(s) 2Mg(s)+Mg2NiH4(s)的△H3= 。
2Mg(s)+Mg2NiH4(s)的△H3= 。
(3)一种用水氯镁石(主要成分为MgCl2·6H2O)制备金属镁工艺的关键流程如下: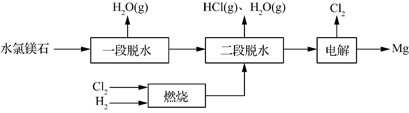
①为探究MgCl2•6H2O“一段脱水”的合理温度范围,某科研小组将MgCl2•6H2O在不同温度下分解,测得残留固体物质的X-射线衍射谱图如下图所示(X-射线衍射可用于判断某晶态物质是否存在)。
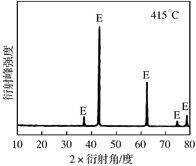
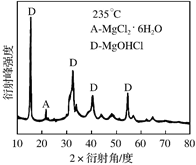
测得E中Mg元素质量分数为60.0%,则E的化学式为 。
②若电解时电解槽中有水分,则生成的MgOHCl与阴极产生的Mg反应,使阴极表面产生MgO钝化膜,降低电解效率。生成MgO的化学方程式为 。
(4)储氢材料Mg(AlH4)2在110~200°C的反应为:Mg(AlH4)2 MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
MgH2 +2A1+3H2↑每生成27gAl转移电子的物质的量为_______________。
(1 6分)钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、
Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下: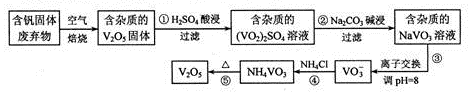
部分含钒化合物在水中的溶解性如下表:
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有
(2)反应②碱浸后滤出的固体主要成分是 (写化学式)。
(3)反应④的离子方程式为
(4)250C、101 kPa时,
用V2O5发生铝热反应冶炼金属钒的热化学方程式是 。
(5)钒液流电池(如图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为 ,电池充电时阳极的电极反应式是 。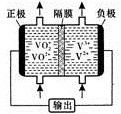
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2 VO2++ H2C2O4+2 H+="2" VO2++2CO2↑+2H2O,取25.00 mL 0.1000 mol/L H2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0 mL,由此可知,该(V02)2S04溶液中钒的含量为 g/L。
一定温度下,在恒容密闭容器中充入2molNO2与1molO2发生反应如下:
4NO2(g)+O2(g) 2N2O5(g)
2N2O5(g)
(1)已知平衡常数K350℃<K300℃,则该反应是_________反应(填“吸热”或“放热”);常温下,该反应能逆向自发进行,原因是_______________________________________。
(2)下列有关该反应的说法正确的是___________。
A.扩大容器体积,平衡向逆反应方向移动,混合气体颜色变深
B.恒温恒容下,再充入2molNO2和1molO2,再次达到平衡时NO2转化率增大
C.恒温恒容下,当容器内的密度不再改变,则反应达到平衡状态
D.若该反应的平衡常数增大,则一定是降低了温度
(3)氮的化合物种类较多,如NH3、NO、NO2、HNO3、硝酸盐等。
①亚硝酸是一种弱酸,能证明亚硝酸是弱电解质的是__________。
A.常温下,亚硝酸钠溶液的pH>7
B.亚硝酸能和NaOH发生中和反应
C.用亚硝 酸 溶液做导电性实验,灯泡很暗
D.常温下,将pH=3的亚硝酸溶液稀释10倍 ,pH<4
②根据酸碱质子理论,凡是能给出质子的分子或离子都是酸,凡是能结合质子的分子或离子都是碱。按照这个理论,下列微粒属于两性物质的是___________。
a.H2O
b.NO2-
c.H2NCH2COOH
d.H2PO4-
e.H2S
③氮同主族磷元素形成的Na2HPO4溶液显碱性,若向溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是___________________________________________(用离子方程式表示)。
(4)X、Y、Z、W分别是HNO3、NH4NO3、NaOH、NaNO2四种强电解质中的一种。下表是常温下浓度均为0.01 mol·L-1的X、Y、Z、W溶液的pH。

将X、Y、Z各1mol·L-1同时溶于水中制得混合溶液,则混合溶液中各离子的浓度由大到小的顺序为 ________________________________________________。
(5)N2O5是一种新型绿色硝化剂,其制备可以用硼氢化钠燃料电池作电源,采用电解法制备得到N2O5,工作原理如图。则硼氢化钠燃料电池的负极反应式为 。
二氧化碳是引起“温室效应”的主要物质,节能减排,高效利用能源,能够减少二氧化碳的排放。
(1)有一种用CO2生产甲醇燃料的方法:
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-b kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-c kJ·mol-1;
H2O(g)=H2O(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_____________________________。
(2)在一定温度下的2L固定容积的密闭容器中,通入2 molCO2和3mol H2,发生的反应为:
CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g)+H2O(g)△H=-a kJ/mol(a>0), 测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
①能说明该反应已达平衡状态的是________。(选填编号)
A.CO2的体积分数在混合气体中保持不变
B.混合气体的平均相对分子质量不随时间的变化而变化
C.单位时间内每消耗1.2mol H2,同时生成0.4molH2O
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且
保持不变
②计算该温度下此反应的平衡常数K=_______。(保留两位有效数字)。若改变条件 (填选项),可使K=1。
A.增大压强
B.增大反应物浓度
C.降低温度
D.升高温度
E.加入催化剂
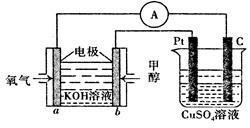
(3)某甲醇燃料电池原理如图1所示。
①M区发生反应的电极反应式为_______________________________。
②用上述电池做电源,用图2装置电解饱和食盐水(电极均为惰性电极),则该电解的总反应离子方程式为: 。假设溶液体积为300mL,当溶液的pH值变为13时(在常温下测定),理论上消耗甲醇的质量为______________(忽略溶液体积变化)。
(14分)甲醇作为基本的有机化工产品和环保动力燃料具有广阔的应用前景,CO2加氢合成甲醇是合理利用CO2的有效途径。由CO2制备甲醇过程可能涉及反应如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H 1=-49.58kJ•mol-1
CH3OH(g) +H2O(g) △H 1=-49.58kJ•mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应Ⅲ:CO(g)+2 H2(g) CH3OH(g) △H 3=-90.77 kJ•mol-1
CH3OH(g) △H 3=-90.77 kJ•mol-1
回答下列问题:
(1)反应Ⅱ的△H2= ,反应I自发进行条件是 (填“较低温”、“较高温”或“任何温度”)。
(2)在一定条件下3L恒容密闭容器中,充入一定量的H2和CO2仅发生反应Ⅰ,实验测得反应物在不同起始投入量下,反应体系中CO2的平衡转化率与温度的关系曲线,如图1所示。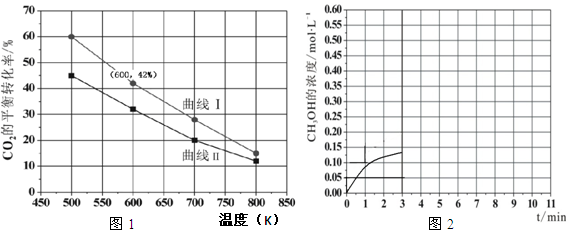
①H2和CO2的起始的投入量以A和B两种方式投入
A:n(H2)=3mol,n(CO2)=1.5mol
B:n(H2)=3mol,n(CO2)=2mol,曲线I代表哪种投入方式 (用A、B表示)
②在温度为500K的条件下,按照A方式充入3mol H2和1.5mol CO2,该反应10min时达到平衡:
a.此温度下的平衡常数为 ;500K时,若在此容器中开始充入0.3molH2和0.9mol CO2、0.6molCH3OH、xmolH2O,若使反应在开始时正向进行,则x应满足的条件是
b.在此条件下,系统中CH3OH的浓度随反应时间的变化趋势如图2所示,当反应时间达到3min时,迅速将体系温度升至600K,请在图2中画出3~10min内容器中CH3OH浓度的变化趋势曲线。
(3)固体氧化物燃料电池是一种新型的燃料电池,它是以固体氧化锆、氧化钇为电解质,这种固体电解质在高温下允许氧离子(O 2-)在其间通过,该电池的工作原理如下图所示,其中多孔电极均不参与电极反应,下图是甲醇燃料电池的模型。
①出该燃料电池的负极反应式
②如果用该电池作为电解装置,当有16g甲醇发生反应时,则理论上提供的电量最多为 (法拉第常数为9.65×104C·mol-1)
能源问题是人类社会面临的重大课题。甲醇是未来重要的绿色能源之一。
(l)已知:在 25 ℃、101 kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ。
请写出甲醇燃烧的热化学方程式 。
(2)由CO2和H2合成甲醇的化学方程式为:
CO2(g)+ 3H2 (g)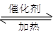 CH3OH(g)+H2O (g )
CH3OH(g)+H2O (g )
在其它条件不变的情况下,实验测得温度对反应的影响如下图所示(注:T1、T2均大于300 ℃)

①合成甲醇反应的△H 0。(填“>”、“<”或“="”" )。
②平衡常数的表达式为: .温度为T2时的平衡常数 温度为T1时的平衡常数(填“>”、“<”或“=”)
③在T1温度下,将1mol CO2和 1 molH2充入一密闭恒容容器中,充分反应达到平衡后,若CO2转化率为α,则容器内的压强与起始压强的比值为 。
(3)利用甲醇燃料电池设计如下图所示的装置。该装置中 Pt 极为 极;写出 b极的电极反应式 .
短周期主族元素A,B,C,D,E,F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C,D是空气中含量最多的两种元素,D,E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期半径最小的元素。试回答以下问题:
(一)(1)D在周期表中的位置是 ,写出实验室制备单质F的离子方程式 。
(2)化学组成为BDF2的电子式为: ,A、C、F三种元素形成的化合物CA4F为 化合物(填 “离子”或“共价”)。
(3)化合物甲、乙由A,B,D,E中的三种或四种组成,且甲、乙的水溶液均呈碱性。则甲、乙反应的离子方程式为: 。
(4)由C,D,E,F形成的简单离子的离子半径由大到小的顺序是 (用元素离子符号表示)。
(5)元素B和F的非金属性强弱,B的非金属性 于F(填“强”或“弱”),并用化学方程式证明上述结论 。
(二)以CA3代替氢气研发氨燃料电池是当前科研的一个热点。
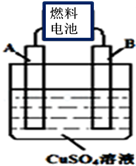
(1)CA3燃料电池使用的电解质溶液是2mol•L﹣1的KOH溶液,电池反应为:4 CA3+3O2=2C2+6H2O.该电池负极的电极反应式为 ;每消耗3.4g CA3转移的电子数目为 。
(2)用CA3燃料电池电解CuSO4溶液,如图所示,A、B均为铂电极,通电一段时间后,在A电极上有红色固体析出,则B电极上发生的电极反应式为 ;此时向所得溶液中加入8gCuO固体后恰好可使溶液恢复到电解前的浓度,则电解过程中收集到的气体在标准状况下体积为 L。
(3)常温下,将除去表面氧化膜的Al、Cu片插入浓HNO3中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示,反应过程中有红棕色气体产生。

图1 图2
0~t1时,原电池的负极是Al片,此时,正极的电极反应式是 ,溶液中的H+向 极移动(填“正”或“负”),t1时,原电池中电子流动方向发生改变,其原因是 。
碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:Ni(s)+4CO(g) Ni(CO)4(g),△H<0;
Ni(CO)4(g),△H<0;
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是_______(填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
| B.缩小容器容积,平衡右移,△H减小 |
| C.反应达到平衡后,充入CO再次达到平衡时,CO的体积分数降低 |
| D.当4v正[Ni(CO)4]=v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒.为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫.
已知:CO(g)+ 1/2O2(g)=CO2(g) △H=-Q1 kJ•mol-1
S(s) +O2(g) =SO2(g) △H=-Q2 kJ•mol-1
则SO2(g) +2CO(g) ="S(s)" +2CO2(g) △H=________________;
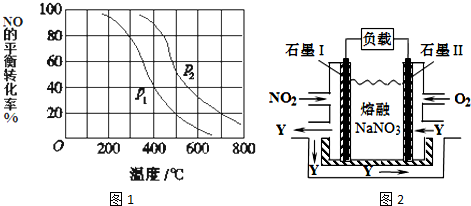
(3)对于反应:2NO(g)+O2═2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图1).
①比较P1、P2的大小关系_______________;
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为_______(最简分数形式);
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图2所示.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为_______________;若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为________L。
硫化氢(H2S)是一种有毒的可燃性气体,用H2S、空气和KOH溶液可以组成燃料电池,其总反应式为2H2S+3O2+4KOH=2K2SO3+4H2O。
(1)该电池工作时正极应通入 。
(2)该电池的负极电极反应式为: 。
(3)该电池工作时负极区溶液的pH (填“升高”“不变”“降低”)
(4)有人提出K2SO3可被氧化为K2SO4,因此上述电极反应式中的K2SO3应为K2SO4,某学习小组欲将电池工作一段时间后的电解质溶液取出检验,以确定电池工作时反应的产物。实验室有下列试剂供选用,请帮助该小组完成实验方案设计。
0.01mol·L-1KMnO4酸性溶液,1mol·L-1HNO3,1mol·L-1H2SO4,1mol·L-1HCl,0.1mol·L-1Ba(OH)2,0.1 mol·L-1 BaCl2。
| 实验步骤 |
实验现象及相关结论 |
| ①取少量电解质溶液于试管中,用pH试纸测其pH。 |
试纸呈深蓝色,经比对溶液的pH约为14,说明溶液中有残余的KOH。 |
| ②继续加入( )溶液,再加入( )溶液,振荡。 |
若有白色沉淀产生,则溶液中含有K2SO4。 若无白色沉淀产生,则溶液中没有K2SO4 |
| ③另取少量电解质溶液于试管中,滴入2~3滴0.01 mol·L-1KMnO4酸性溶液,振荡 |
( ) |
(5)若电池开始工作时每100mL电解质溶液含KOH 56g,取电池工作一段时间后的电解质溶液20.00mL,加入BaCl2溶液至沉淀完全,过滤洗涤沉淀,将沉沉在空气中充分加热至恒重,测得固体质量为11.65g,计算电池工作一段时间后溶液中KOH的物质的量浓度( )。(结果保留四位有效数字,假设溶液体积保持不变,已知:M(KOH)=56,M(BaSO4)=233,M(BaSO3)=217)
试题篮
()