25℃时,浓度为0.1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性。下列判断一定正确的是 ( )
| A.HA酸溶液的pH值一定等于1 | B.HA酸溶液的物质的量浓度一定等于0.1mol/L |
| C.中和后溶液中M+离子浓度一定等于A-离子浓度 | D.中和后生成的盐MA一定没有发生水解 |
在纯水中存在如下平衡:2H2O<==>H3O++OH-,若使水的电离平衡向逆方向移动,且使溶液中的pH减小,应加入下列的(双选) ( )
| A.NH4Cl | B.KHSO4 | C.NaOH | D.HCl |
CH3COOH与CH3COONa等物质的量混合配制成的稀溶液,pH为4.7。下列说法错误的是 ( )
| A.CH3COOH的电离作用大于CH3COONa的水解作用 |
| B.CH3COONa的水解作用大于CH3COOH的电离作用 |
| C.CH3COOH的存在抑制了CH3COONa的水解 |
| D.CH3COONa的存在抑制了CH3COOH的电离 |
将pH=1的盐酸平均分成2份,1份加入适量水,另一份加入与该盐酸物质的量浓度相同的适量NaOH溶液后,pH都升高了1,则加入的水与NaOH溶液的体积比为( )
| A.9:1 | B.10:1 | C.1l:1 | D.12:l |
t℃时,水的离子积为Kw。在该温度下,混合可溶性的一元酸HA和一元碱BOH的溶液,下列有关混合液的各种关系中,可确认混合液呈中性的是
| A.pH=7 | B.C(A-)>c(B+) |
C.C(OH-)=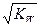 |
D.C(H+)- C(OH-)=C (A-)- C(B+) |
100℃时水的离子积Kw=1×10-12。这时将等体积硫酸和氢氧化钠溶液混合,若溶液混合后显中性,则混合前硫酸的pH和氢氧化钠溶液的pH之和为
| A.12 | B.14 | C.13 | D.15 |
下列各选项中所述的两个量,前者一定大于后者的是
| A.将pH=4的盐酸和醋酸分别稀释成pH=5的溶液,所加水的量 |
| B.pH=10的NaOH和Na2CO3溶液中,水的电离程度 |
C.物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中NH 的物质的量浓度 的物质的量浓度 |
| D.相同温度下,10mL 0.1mol/L的醋酸与100mL 0.01mol/L的醋酸中H+的物质的量 |
(8分)在T℃时,水的离子积为KW=10—12,在此温度下,将pH=a的盐酸溶液Va L与pH=b的Ba(OH)2溶液Vb L混合:
(1)由数据可以判断T 25(填“大于” 、“小于”、“等于”);理由是: 。
(2)若所得混合液为中性,且a+b=10,则Va︰Vb为 ;
(3)若所得混合液的pH=10,且a=2,b=12则Va︰Vb为 。
将一定体积的某NaOH溶液分成两等份,一份用pH=2的一元酸HA溶液中和,消耗酸溶液的体积为V1;另一份用pH=2的一元酸HB溶液中和,消耗酸溶液体积为V2,则下列叙述正确的是
| A.若V1>V2,则说明HA的酸性比HB的酸性强 |
| B.若V1>V2,则说明HA的酸性比HB的酸性弱 |
| C.因为两种酸溶液的pH相等,故V1一定等于V2 |
| D.若将两种酸溶液等体积混合,混合酸溶液的pH一定等于2 |
T℃时,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2,下列叙述不正确的是
| A.此时水的离子积Kw=1×10-12 |
| B.水电离出的c(H+)=1×10-10 mol/L |
| C.水的电离度随温度升高而增大 |
| D.若加入等体积pH=12的NaOH溶液,溶液呈中性 |
试题篮
()