常温时,向pH=2的硫酸中加入等体积的下列溶液后,滴入甲基橙试液,出现红色,该溶液可能是
| A.pH=12的Ba(OH)2 | B.pH=12的氨水 |
| C.0.05moL/L BaCl2 | D.0.01mol/L NaOH |
在标有“20℃,25mL”的滴定管内装溶液至刻度“0”时,管内液体的体积
| A.约为5mL | B.大于25mL | C.等于25mL | D.小于25mL |
现有常温下的四份溶液: ① 0.01 mol/L CH3COOH ② 0.01 mol/LHCl ③pH=12的氨水 ④ pH=12的NaOH溶液,下列说法正确的是
| A.①中水的电离程度最小,③中水的电离程度最大 |
| B.将四份溶液稀释相同倍数后,溶液的pH:②﹥①,③﹥④ |
| C.将②③混合,若pH=7,则消耗溶液的体积:②﹥③ |
| D.将①、④混合,若有c(CH3COO-)﹥c(H+),则混合液一定呈碱性 |
下列说法正确的是
A.将标准状况下的2.24L CO2通入150mL 1mol·L-1 NaOH溶液中,所得溶液中c(CO32-)>c(HCO3-)
B.常温下0.1 mol·L-1的下列溶液①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
C.0.1 mol·L-1 pH为9的NaHB溶液中:c(HB-)>c(B2-)>c(H2B)
D.室温下,将0.4mol/L HA溶液和0.2mol/LNaOH溶液等体积混合(忽略混合时溶液体积的变化)测得混合液pH=5,则c(A-)+c (OH-)>c (H+) + c(HA)
下表中实验操作、现象和所得出的结论均正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋, |
红色很快褪为无色 |
随溶液pH减小,NaClO的氧化能力增强 |
| B |
向氯化亚铁溶液中加入Na2O2粉末, |
出现红褐色沉淀 |
说明原氯化亚铁己氧化变质 |
| C |
苯酚和水的浊液中,加Na2CO3溶液, |
溶液变澄清 |
苯酚的酸性比碳酸强 |
| D |
向溶液X中加入NaHCO3粉末, |
产生无色气体 |
溶液X的溶质一定属于酸 |
常温下,将等体积,等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A. <1.0×10-7mol/L <1.0×10-7mol/L |
| B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3) |
| C.c(H+)+c(NH4+)>c(OH-)+ c(HCO3-)+2 c(CO32-) |
| D.c(Cl-)> c(HCO3-) >c(NH4+) > c(CO32-) |
滴定法是化学上常用的定量分析的方法。滴定的方法有酸碱中和滴定、氧化还原滴定、沉淀滴定、络合滴定等。
I.甲化学兴趣小组取20.00mL待测稀盐酸放入锥形瓶中,并滴加2~3滴酚酞溶液作指示剂,用0.2000 mol·L-1的标准NaOH溶液进行滴定。重复上述滴定操作3次,并记录数据。
(1)滴定时边滴边摇动锥形瓶,眼睛应观察________。(填序号)
A.滴定管内液面的变化 B.锥形瓶内溶液颜色的变化
(2)判断滴定终点的现象是:_____________________。
(3)根据下列数据:请计算待测盐酸溶液的浓度为________mol/L。
| 滴定次数 |
待测液体积(mL) |
标准NaOH溶液读数记录(mL) |
|
| 滴定前读数 |
滴定后读数 |
||
| 第一次 |
20.00 |
0.40 |
20.40 |
| 第二次 |
20.00 |
4.00 |
24.00 |
| 第三次 |
20.00 |
2.00 |
24.10 |
II.乙化学兴趣小组利用氧化还原反应滴定,测定了某工厂废水中游离态氯的含量。实验如下:
①取水样10.0 ml于锥形瓶中,加入10.0 ml的KI溶液(足量),滴入指示剂2~3滴。
②将自己配制的0.01mol·L-1标准Na2S2O3溶液装入滴定管中,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3="2NaI+" 2Na2S4O6。试回答下列问答:
(1)步骤①发生的化学反应方程式为:_______________;加入的指示剂是_______。
(2)步骤②应使用_________式滴定管。
(3)氯的所测浓度比实际浓度会偏大,造成误差的原因可能是______(填序号)
A 配制标准Na2S2O3溶液定容时,加水超过刻度线
B 锥形瓶水洗后直接装待测水样
C 装标准Na2S2O3溶液的滴定管水洗后没有润洗
D 滴定到达终点时,俯视读出滴定管读数;
E 滴定前尖嘴部分有气泡,滴定后消失
III.沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下表,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 |
AgCl |
AgBr |
AgI |
Ag2S |
Ag2CrO4 |
| 颜色 |
白色 |
浅黄色 |
黄色 |
黑色 |
红色 |
| Ksp |
2.0×10-10 |
5.4×10-13 |
8.3×10-17 |
2.0×10-48 |
2.0×10-12 |
(1)滴定时,你认为该滴定适宜选用的指示剂是下列中的___________。(填序号)
A.KBr B.KI C.K2S D.K2CrO4
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,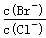 =__________。
=__________。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
| 实验编号 |
HA物质的量浓度/(mol·L-1) |
NaOH物质的量浓度/(mol·L-1) |
混合溶液的pH |
| 甲 |
c |
0.2 |
pH=7 |
| 乙 |
0.2 |
0.1 |
pH>7 |
| 丙 |
0.1 |
0.1 |
pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,c是否一定等于0.2________(选填“是”或“否”)。
(2)单从乙组实验结果分析,HA是________酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是_______________。
(3)丙组实验所得混合溶液中下列算式的精确结果:c(OH-)-c(HA) =_________mol/L。
浓度均为0.10mol/L、体积均为v0的MOH和ROH溶液,分别加水稀释至体积v,pH随 的变化如图所示,下列叙述错误的是
的变化如图所示,下列叙述错误的是
| A.MOH的碱性强于ROH的碱性 |
| B.ROH的电离程度:b点大于a点 |
| C.若两溶液无限稀释,则它们的c(OH-)相等 |
D.当 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 =2时,若两溶液同时升高温度, 则c(M+)/c(R+)增大 |
在25℃时将pH=11的NaOH溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是
| A.c (Na+)=c(CH3COO-)+c(CH3COOH) |
| B.c(H+)=c(CH3COO-)+c(OH-) |
| C.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| D.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) |
用中和滴定法测定某烧碱样品的纯度,试根据实验回答下列问题:
(1)准确称量8.6g含有少量中性易溶杂质的样品,配成500 mL待测溶液。称量时,样品可放在________(填编号字母)称量。
A.托盘上 B.洁净纸片上 C.小烧杯中
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,不可选用_______(填编号字母)作指示剂。
A.石蕊 B.甲基橙 C.酚酞
(3)滴定过程中,眼睛应注视______________;在铁架台上垫一张白纸,其目的是 。
(4)根据下表数据,计算被测烧碱溶液的物质的量浓度是________mol·L-1,烧碱样品的纯度是_______。
| 滴定次数 |
待测溶液 体积(mL) |
标准酸体积 |
|
| 滴定前的刻度(mL) |
滴定后的刻度(mL) |
||
| 第一次 |
10 |
0.5 |
20.6 |
| 第二次 |
10 |
4.2 |
24.1 |
(5)下列实验操作会对滴定结果产生什么影响(填“偏高”、“偏低”或“无影响”)?
①滴定前酸式滴定管尖嘴处有气泡,滴定后充满溶液 ;
②读取标准溶液体积时,滴定前仰视,滴定终点时平视 。
(1)常温下,0.1 mol/L的醋酸和0.1 mol/L的盐酸各100 mL,分别与足量的锌粒反应,产生的气体体积前者 后者(填“<”、“>”或“=”).
(2)将体积和物质的量浓度都相同的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸”,“中”或“碱”下同),溶液中 c(Na+ ) c(CH3 COO- )(填“ >” 或“=”或“<”,下同 )。
(3)pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,溶液中c(Na+) c(CH3COO- )
(4)用Al2(SO4)3 与NaHCO3 溶液混合反应就是泡沫灭火器的工作原理,请写出反应的离子方程式___________。
25℃时,浓度为0. 1mol/L的某一元强碱MOH溶液与相同体积的某一元酸HA溶液混合后恰好呈中性。下列判断一定正确的是
| A.HA酸溶液的pH值一定等于1 |
| B.HA酸溶液的物质的量浓度一定等于0.1mol/L |
| C.中和后溶液中M+离子浓度一定等于A-离子浓度 |
| D.中和后生成的盐MA一定没有发生水解 |
下列说法正确的是
| A.25℃时,pH=3的CH3COOH溶液加水稀释10倍后,pH=4 |
| B.25℃时,pH=11的NaOH溶液加水稀释100倍后,pH=9 |
| C.25℃时,pH=3的CH3COOH溶液与pH=11的NaOH溶液等体积混合后,pH=7 |
| D.90℃时,纯水的pH=6.2,所以加热可以使水呈酸性 |
25℃时,水的电离达到平衡:H2O H++OH-;DH>0,则下列叙述正确的是
H++OH-;DH>0,则下列叙述正确的是
| A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低 |
| B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变 |
| C.向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低 |
| D.将水加热,KW增大,pH不变 |
试题篮
()