现有物质的量浓度均为 0.1 mol·L - 1 的四种溶液各25mL:①氨水 ②NH4Cl 溶液
③Na2CO3溶液 ④NaHCO3溶液,下列说法正确的是:
| A.4种溶液pH的大小顺序:①>④>③>② |
| B.①、②混合后pH>7,则混合溶液中c(NH4+)<c(NH3·H2O) |
| C.①、②中分别加入25mL 0.1 mol·L – 1盐酸后,溶液中c(NH4+):①>② |
| D.③、④中分别加入12.5mL 0.1 mol·L – 1NaOH溶液后,两溶液中离子种类相同 |
下列溶液中粒子的物质的量浓度关系正确的是:
| A.0.1 mol·L - 1 NaHC2O4溶液与0.1 mol·L – 1KOH溶液等体积混合,所得溶液中: c(Na+)>c(K+) >c(C2O42-) >c(OH-) >c(HC2O4-) |
| B.20mL 0.1 mol·L - 1NH4Cl溶液与10mL 0.1 mol·L - 1NaOH溶液混合后溶液呈碱性,所得溶液中:c(Cl-)>c(NH4+) >c(Na+)>c(OH-)>c(H+) |
| C.常温下,pH=2的HF溶液与pH=12的氢氧化钠溶液等体积混合,所得溶液中: c(Na+)+ c(OH-) >c(H+)+ c(F-) |
| D.0.1 mol·L – 1 NH3·H2O溶液与0.1 mol·L – 1 HNO3溶液等体积混合,所得溶液中: |
c(H+) >c(OH-) + c(NH3·H2O)
下列有关电解质溶液中粒子浓度关系正确的是
| A.pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) |
| B.含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) |
| C.CO2的水溶液:c(H+)>c(HCO3-)=2c(CO32-) |
| D.含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)=2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
下列说法正确的是
| A.在一定温度下AgCl水溶液中,Ag+和Cl-浓度的乘积是一个常数 |
| B.在任何含AgCl固体的溶液中都存在c(Ag+) = c(Cl-) |
| C.温度一定,当溶液中存在c(Ag+),c(Cl-)=Ksp时,此溶液为AgCl的饱和溶液 |
| D.向饱和AgCl水溶液中加入盐酸,其Ksp值变大 |
下列化学用语正确的是
A.NaHCO3的水解:HCO3-+H2O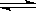 H3O++CO32- H3O++CO32- |
B.醋酸铵的电离:CH3COONH4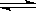 CH3COO-+NH4+ CH3COO-+NH4+ |
| C.H2的燃烧热为285.8kJ/mol:H2(g)+ 1/2O2(g)=H2O(g);△H=-285.8kJ/mol |
D.碳在高温下还原二氧化硅 SiO2+2C Si+2CO↑ Si+2CO↑ |
25 ℃时,pH=7的(NH4)2SO4与NH3·H2O的混合溶液中,c(NH)与c(SO)之比是
| A.小于2∶1 | B.大于2∶1 | C.等于2∶1 | D.无法判断 |
HA为酸性略强于醋酸的一元弱酸,在0.1 mol·L-1 NaA溶液中,离子浓度关系正确的是
| A.c(Na+)>c(A-)>c(H+)>c(OH-) |
| B.c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.c(Na+)+c(H+)=c(A-)+c(OH-) |
| D.c(Na+)+c(OH-)=c(A-)+c(H+) |
下面的问题中,与盐类水解有关的是
①为保存FeCl3溶液,要在溶液中加入少量盐酸;
②实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡胶塞;
③在NH4Cl或AlCl3溶液中加入镁条会产生气泡;
④长期使用硫酸铵,土壤酸性增强。
| A.只有①④ | B.只有②③ | C.只有③④ | D.全部 |
将下列物质的溶液在蒸发皿中加热蒸干并灼烧(400 ℃),可以得到该物质的固体的是
| A.AlCl3 | B.NaHCO3 | C.KMnO4 | D.MgSO4 |
为了使Na2S溶液中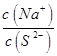 的比值变小,可采取的措施是
的比值变小,可采取的措施是
①适量盐酸 ②适量NaOH(s) ③适量KOH(s) ④适量KHS(s)
⑤加水 ⑥通H2S(g) ⑦加热
| A.③④ | B.①②⑤⑥⑦ | C.②③ | D.②③④ |
0.1 mol·L-1 Na2CO3溶液和0.1 mol·L-1 NaHCO3溶液的pH的大小关系是
| A.前者小 | B.相等 | C.前者大 | D.不能肯定 |
试题篮
()