下列方程式书写正确的是( )
| A.HCO3﹣在水溶液中的电离方程式:HCO3﹣+H2O⇌H3O++CO32﹣ |
| B.H2SO3的电离方程式:H2SO3⇌2H++SO32﹣ |
| C.CO32﹣的水解方程式:CO32﹣+2H2O⇌H2CO3+2OH﹣ |
| D.NaHCO3的电离方程式:NaHCO3═Na++H++CO32﹣ |
在25℃时将pH=11 的NaOH 溶液与pH=3 的CH3COOH溶液等体积混合后,下列关系式中正确的是( )
| A.c (Na+)==c(CH3COO-)+c(CH3COOH) |
| B.c(H+)==c(CH3COO-)+c(OH一) |
| C.c (Na+) > c (CH3COO-)>c(OH-)>c(H+) |
| D.c (CH3COO-)>c(Na+)>c(H+)>c(OH-) |
下列溶液显酸性的是( )
①pH<7的溶液 ②c(H+)=c(OH-)的溶液 ③c(H+)=1×10-6 mol·L-1的溶液 ④c(H+)>c(OH-)的溶液⑤0.1 mol·L-1的NH4Cl溶液 ⑥NaHCO3溶液
| A.①③④⑤⑥ | B.②④⑤⑥ | C.⑤⑥ | D.④⑤ |
25℃时,Kw=1.0×10﹣14;100℃时,Kw=5.5×10﹣13.下列说法正确的是( )
| A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4恰好中和,所得溶液的pH=7 |
| B.25℃时,0.2 mol/L Ba(OH)2溶液和0.2 mol/L HCl等体积混合,所得溶液的pH=7 |
| C.25℃时,0.2 mol/L NaOH溶液与0.2 mol/L CH3COOH恰好中和,所得溶液的pH=7 |
| D.25℃时,pH=12的氨水和pH=2的H2SO4等体积混合,所得溶液的pH>7 |
下列说法正确的是( )
| A.泡沫灭火器中用的是硫酸铝和苏打溶液,并且苏打放在小塑料桶里。 |
B.图①表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化 |
| C.在常温下用惰性电极电解足量食盐水的实验中,若电解后溶液总体积为0.5L,阴极析出的气体的分子数为0.5NA,电解后溶液的pH为14 |
| D.常温时,浓度均为0.01mol/L Na2CO3溶液和NaHCO3溶液,等体积混合,其溶液中粒子浓度关系为2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3) |
下列两种溶液混合后,所得溶液中各离子浓度关系不正确的是( )
| A.0.1 mol/L的NaOH溶液与0.1 mol/L的CH3COOH溶液等体积混合c(Na+)>c(OH-)>c(CH3COO-)>c(H+) |
| B.常温下,0.01 mol/L的NaOH溶液与pH=2的CH3COOH溶液等体积混合c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| C.常温下,0.1 mol/L的CH3COOH溶液与0.1 mol/L的NaOH溶液混合后使pH=7,c(CH3COO-)=c(Na+)>c(H+)=c(OH-) |
| D.0.1 mol/L的CH3COOH溶液和0.1 mol/L的CH3COONa溶液等体积混合c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
常温下,VL pH=2的盐酸与0.2L pH=12的氨水混合,若所得溶液显酸性,下列有关判断正确的是( )
| A.V一定等于0.2 |
| B.V大于或等于0.2,也有可能小于0.2 |
| C.混合溶液中离子浓度一定满足:c(Cl-)>c(NH4+)> c(H+)>c(OH-) |
| D.混合溶液中离子浓度可能满足:c(Cl-)> c(H+)> c(NH4+) >c(OH-) |
保持温度不变,用惰性电极电解足量饱和的Na2CO3溶液,一段时间后下列叙述正确的是( )
| A.Na2CO3溶液的碱性增强 |
| B.阳极反应:CO32--2e-+H2O = CO2↑+2OH- |
C.溶液中CO32-+H2O  HCO3-+OH-平衡不移动 HCO3-+OH-平衡不移动 |
| D.向溶液中加入一定量HCOOH的能复原 |
下列叙述或表示正确的是( )
| A.0.1mol·L﹣1的醋酸的pH=a,0.01mol·L﹣1的醋酸的pH=b,则a+1=b |
| B.常温下0.1mol·L﹣1的醋酸溶液与等浓度等体积NaOH溶液反应后的溶液中:c(CH3COOH)+c(CH3COO﹣)=0.1mol·L﹣1 |
| C.难溶电解质AB2的饱和溶液中,已知:c(A2+)="x" mol·L﹣1,c(B﹣)="y" mol·L﹣1,则Ksp值为4xy2 |
| D.用200mL4mol·L﹣1的NaOH溶液将0.6mol CO2完全吸收,反应的离子方程式为: 3CO2+4OH﹣=CO32﹣+2HCO3﹣+H2O |
亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3  H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ + H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式____________________________。
②某温度下,0.1000 mol·L-1的H3PO3溶液pH的读数为1.6,即此时溶液中
c (H+) = 2.5×10-2 mol·L-1,除OH-之外其他离子的浓度由小到大的顺序是 ,该温度下H3PO3电离平衡的平衡常数K= 。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
③向H3PO3溶液中滴加NaOH溶液至中性,所得溶液中
c(Na+)_______ c(H2PO3-)+ 2c(HPO32-)(填“>”、 “<” 或“=”)。
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式_______________________。
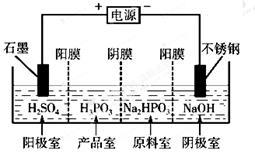
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为________________________。
②产品室中反应的离子方程式为________________。
今有120 mL, 0.20 mol/L Na2CO3的溶液和某浓度的200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是( )
| A.1.5 mol/L | B.2.0mol/L | C.0.18 mol/L | D.0.24mol/L |
试题篮
()